
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выведите барометрическую формулу. Получите из нее закон Больцмана для распределения частиц во внешнем силовом потенциальном поле.
|
|
|
|
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно р (рис. 67), то на высоте h+dh оно равно p+dp (при dh>0 dp<0, так как давление с высотой убывает). Разность давлений р и p+dp равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1 м2:  где r — плотность газа на высоте h (dh настолько мало, что при изменении высоты в этом пределе плотность газа можно считать постоянной). Следовательно,
где r — плотность газа на высоте h (dh настолько мало, что при изменении высоты в этом пределе плотность газа можно считать постоянной). Следовательно,  (45.1). Воспользовавшись уравнением состояния идеального газа pV=(m/M) RT (т — масса газа, М — молярная масса газа), находим, что
(45.1). Воспользовавшись уравнением состояния идеального газа pV=(m/M) RT (т — масса газа, М — молярная масса газа), находим, что 
Подставив это выражение в (45.1), получим 
С изменением высоты от h1 до h2 давление изменяется от р1 до р2 (рис. 67), т. е.
 или
или  (45.2)
(45.2)  (45.3)
(45.3)
Выражение (45.2) называется барометрической формулой.
Барометрическую формулу (45.3) можно преобразовать, если воспользоваться выражением p=nkT:
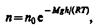 где n – концентрация молекул на высоте h, n0 – то же, на высоте h=0. Так как M=m0NA (NA – постоянная Авогадро, т0 – масса одной молекулы), a R=kNA, то
где n – концентрация молекул на высоте h, n0 – то же, на высоте h=0. Так как M=m0NA (NA – постоянная Авогадро, т0 – масса одной молекулы), a R=kNA, то  (45.4), где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.
(45.4), где m0gh=П — потенциальная энергия молекулы в поле тяготения, т. е.  45.5)
45.5)
Выражение (45.5) называется распределением Больцмана для внешнего потенциального поля.
37.Что называют числом степеней свободы молекулы? Чему оно равно для молекулы, содержащей  атомов (
атомов ( = 1, 2 и более)? Сформулируйте закон равнораспределения энергии по степеням свободы молекулы. Что называют внутренней энергией и чему равна внутренняя энергия идеального газа в зависимости от его количества, числа атомов в молекул и характера их движения?
= 1, 2 и более)? Сформулируйте закон равнораспределения энергии по степеням свободы молекулы. Что называют внутренней энергией и чему равна внутренняя энергия идеального газа в зависимости от его количества, числа атомов в молекул и характера их движения?
Число независимых координат, полностью определяющих положение точки в пространстве, называется числом степеней свободы. Если материальная точка свободно движется в пространстве, то, как уже было сказано, она обладает тремя степенями свободы (координаты х, у и z), если она движется по некоторой поверхности, то двумя степенями свободы, если вдоль некоторой линии, то одной степенью свободы.
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень «обладает» вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы. Таким образом, средняя энергия молекулы  где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:  В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий Na молекул:
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы. Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий Na молекул:  (50.1). Внутренняя энергия для произвольной массы т газа.
(50.1). Внутренняя энергия для произвольной массы т газа.

Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 119; Нарушение авторских прав?; Мы поможем в написании вашей работы!