
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие положения и понятия
|
|
|
|
Химическое равновесие
(термодинамика систем с химическими реакциями)
Первым идею обратимости химических реакций сформулировал Бертолле (1799), который показал в своем докладе об исследовании законов сродства, что на направление протекания химических процессов влияет соотношение масс реагирующих веществ. Позже Бекетов (1865) доказал, что взаимодействие уксусной кислоты с карбонатом кальция протекает обратимо, причем равновесие данной реакции определяется давлением углекислого газа в системе. В это же время Гульдберг (1864) и Гааге (1867) сформулировали закон действующих масс (кинетический вывод) и показали, что в химической системе возможно установление равновесия, достижимое с обеих сторон. В 1877 г. Вант-Гофф доказал закон действующих масс на основе положений термодинамики, используя метод цикла.
Под химическим сродством понимают способность веществ вступать в химическое взаимодействие. Предложения использовать в качестве величины, определяющей химическое сродство, скорость химической реакции (Венцель, 1877 г.) и количество выделившейся теплоты (Томсен и Бертло, 1854 г.) оказались неудачными по целому ряду объективных причин, например: скорость реакции зависит не только от природы реагентов, но и от внешних факторов и концентрации веществ; возможны не только экзотермические, но и эндотермические реакции и т. д.
В настоящее время за меру химического сродства принимают критерии самопроизвольности протекания процессов – изменения характеристических функций (термодинамических потенциалов). Если изменение характеристической функции меньше нуля, то реакция протекает в прямом направлении. Если ее изменение становится равным нулю, то в системе наступает равновесие. Так, например, в изобарно-изотермичес-кой системе критерием самопроизвольности протекания процесса будет dG < 0, в изохорно-изотермической системе – dА < 0 и т. д. Следует отметить, что в заданных условиях убыли указанных функций равны максимальной полезной работе системы:
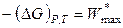 ,
,  .
.
Следовательно, за меру химического сродства может быть принята и величина совершенной системой работы.
В современной физической химии химическое сродство W ' определяют взятой с обратным знаком частной производной от характеристической функции по химической переменной ξ при постоянстве соответствующих естественных переменных:
 .
.
Химическую переменную ξ иначе называют числом пробегов реакции или степенью полноты реакции. Величина ξ количественно характеризует превращение реагирующих веществ в продукты реакции к данному моменту времени. Далее, если W ' > 0, то химическая реакция протекает слева направо (в прямом направлении); если W ' > 0, то химическая реакция протекает справа налево (в обратном направлении). Если в системе протекает химическая реакция и W ' = 0, то наступает химическое равновесие: скорости прямой и обратной реакций становятся одинаковыми, а число частиц в системе остается постоянным (до тех пор, пока не изменились внешние условия).
Химическое равновесие динамично и подвижно. С изменением внешних параметров равновесие сдвигается в определенном направлении и возвращается в исходное состояние, если параметры принимают исходные значения. С термодинамической точки зрения реакции могут протекать как обычные термодинамические равновесные процессы, поэтому к описанию химического равновесия можно применять общие условия равновесия в закрытых системах.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 429; Нарушение авторских прав?; Мы поможем в написании вашей работы!