
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие условия химического равновесия
|
|
|
|
Состав закрытой системы может изменяться только при протекании в ней химической реакции, например
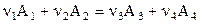 ,
,
или в общем виде
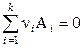 , (11.1)
, (11.1)
где стехиометрические коэффициенты для продуктов реакции берутся со знаком «плюс», а для исходных веществ – со знаком «минус».
Полный дифференциал энергии Гиббса такой системы (системы с химической реакцией) равен (см. п. 6.1)
 . (11.2)
. (11.2)
Поскольку в системе протекает реакция, то изменение чисел молей компонентов (участников реакции) dni будет пропорционально стехиометрическим коэффициентам. При этом очевидно, что отношение изменения числа молей данного компонента к его стехиометрическому коэффициенту для всех участников реакции будет одинаковым:
 , (11.3)
, (11.3)
или в общем виде
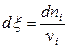 ,
,  (11.4)
(11.4)
В данных условиях химическую переменную ξ принимают равной нулю в начальный момент реакции и равной единице, когда в реакцию вступило число молей веществ, равное стехиометрическим коэффициентам (иными словами, реакция совершила один пробег). Изменение термодинамических функций в реакциях вычисляют всегда для ξ = 1.
После подстановки выражения (11.4) в уравнение (11.2) получаем:
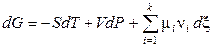 . (11.5)
. (11.5)
Следовательно, энергия Гиббса становится функцией уже только трех переменных:
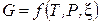 .
.
Введение химической переменной позволило уменьшить число независимых переменных благодаря тому, что массы реагентов изменяются не произвольным образом, а в соответствии с соотношением (11.3). Полный дифференциал энергии Гибсса как функции трех переменных равен
 . (11.6)
. (11.6)
Сопоставление выражений (11.5) и (11.6) приводит к следующим соотношениям:
 ,
, 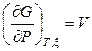 ,
,
 . (11.7)
. (11.7)
Выражение (11.7) пределяет направление химической реакции в изобарно-изотермической системе. Если реакция протекает самопроизвольно в прямом направлении, то dG < 0 и
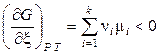 .
.
Если в системе устанавливается равновесие, то энергия Гиббса системы принимает минимальное значение, dG = 0 и
 .
.
Равенство
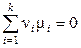 (11.8)
(11.8)
выражает общее условие химического равновесия, посольку при его выводе не имело значения, какова природа участников реакции. Например, для реакции
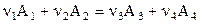
условие химического равновесия принимает вид
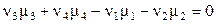 .
.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1633; Нарушение авторских прав?; Мы поможем в написании вашей работы!