
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В различных обратимых и необратимых процессах
|
|
|
|
Работа расширения идеальных газов
Рассмотрим систему, которая характеризуется только одним внешним параметром – объемом (простую систему). Единственно возможная работа расширения такой системы
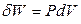
будет зависеть от характера протекающего в ней процесса. Если условия протекания процесса известны, то для конечного изменения состояния системы справедливо:
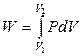 . (2.11)
. (2.11)
Величина работы расширения определяется видом функции P = f (V), т.е. типом процесса. Интеграл находится аналитически на основе опытных данных по зависимости объема от давления или по известному уравнению состояния системы.
Рассмотрим, чему равна равна расширения в некоторых процессах.
Изохорныйпроцесс: V = const. Тогда dV = 0, δW = 0 и
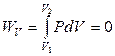 .
.
Следовательно,
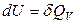 . (2.12)
. (2.12)
В изохорном процессе, когда системой выполняется только работа расширения, подводимая к системе теплота полностью идет на увеличение внутренней энергии:
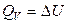 .
.
Следовательно, в изохорных процессах количество теплоты не зависит от пути протекания процесса, а величина δQV обладает свойствами полного дифференциала.
Изобарный процесс: Р = const. Работа расширения такого процесса не равна нулю:
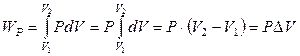 , (2.13)
, (2.13)
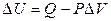 .
.
Выражение для работы (2.13) можно преобразовать, если известно уравнение состояния системы. Если система – идеальный газ, то РV = nRT и
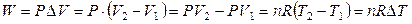 . (2.14)
. (2.14)
Для одного моля идеального газа при изменении его температуры на 1 К при постоянном давлении работа расширения равна универсальной газовой постоянной:
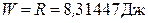 .
.
Адиабатический процесс: δQ = 0; Q = 0.Уравнение первого закона термодинамики записывается в виде
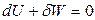 ,
, 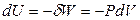 ,
, 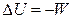 , (2.15)
, (2.15)
т.е. положительная работа расширения совершается за счет убыли внутренней энергии системы.
Джоуль установил, что внутренняя энергия идеального газа является функцией только температуры и не зависит от объема и давления:
|
|
|
U = f (T) – закон Джоуля,
поэтому
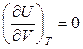 и
и 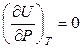 . (2.16)
. (2.16)
Но
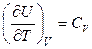 ,
,
где 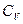 – изохорная теплоемкость. Поэтому уравнение (2.16) можно записать и так
– изохорная теплоемкость. Поэтому уравнение (2.16) можно записать и так
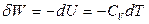 или
или 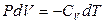 . (2.17)
. (2.17)
Теплоемкость идеального газа не зависит от температуры. Тогда, если СV – молярная теплоемкость, то для адиабатического процесса 1 моль идеального газа справедливо:
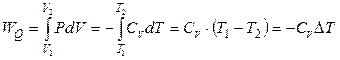 . (2.18)
. (2.18)
Изотермический процесс: Т = const. Для вычисления работы расширения в изотермическом процессе по уравнению
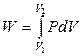 .
.
необходимо знать уравнение состояния системы j (P, V, T) = 0.
Если система – идеальный газ и проводится обратимое (равновесное) расширение или сжатие этого газа (в любой момент времени давление газа лишь на бесконечно малую величину отличается от внешнего давления), то
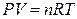 ,
, 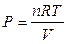 ,
,
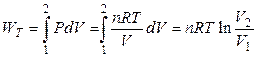 . (2.19)
. (2.19)
Поскольку в изотермическом процессе 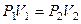 , то
, то 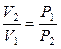 и
и
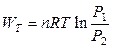 . (2.20)
. (2.20)
Первый закон термодинамики для изотермического расширения идеального газа с учетом закона Джоуля (U = const при T = const, dUТ = 0) запишется
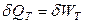 ,
, 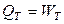 . (2.21)
. (2.21)
Подводимая в изотермическом процессе к идеальному газу теплота расходуется на совершение работы расширения.
Следует отметить, однако, что работа расширения идеального газа в вакуум равна нулю, так как при этом газ не преодолевает никакого сопротивления (и температура газа при этом остается постоянной).
Стоит подчеркнуть, что при необратимом (неравновесном) изотермическом расширении (сжатии) газа против постоянного внешнего давления Pвн работа будет вычисляться по формуле
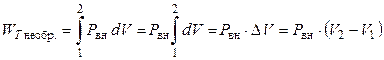 . (2.22)
. (2.22)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 780; Нарушение авторских прав?; Мы поможем в написании вашей работы!