
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость
|
|
|
|
Отношение количества теплоты δQ, полученной веществом при бесконечно малом изменении его состояния в каком-либо процессе, к изменению температуры dT вещества называется теплоемкостью (символ С, единица Дж/К):
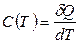 .
.
Теплоемкость системы – экстенсивная величина. Теплоемкость, отнесенная к единице массы или количества вещества, становится интенсивным параметром. Теплоемкость единицы массы (кг, г) называется удельной (единица Дж/(кг К) и Дж/(г К)), а теплоемкость 1 моль вещества – молярной теплоемкостью (единица Дж/(моль К)).
Различают истинную С = δQ / dT и среднюю теплоемкость
 .
.
Средняя и истинная теплоемкости связаны соотношением
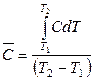 (2.37)
(2.37)
Количество теплоты, поглощенное телом при изменении его состояния, зависит не только от начального и конечного состояния тела (в частности, от температуры), но и от условий перехода между этими состояниями. Следовательно, от условий нагревания тела зависит и его теплоемкость.
Поэтому:
В изотермическом процессе (Т = const):
 ;
;
(при подводе теплоты 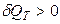 и
и 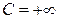 , и наоборот)
, и наоборот)
В адиабатическом процессе (δQ = 0):
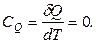
На практике используют теплоемкость при постоянном объеме – изохорную теплоемкость СV и теплоемкость при постоянном давлении – изобарную теплоемкость СР, если процесс проводят при постоянном объеме или при постоянном давлении.
При V = const (изохорный процесс):
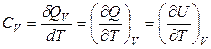 . (2.38)
. (2.38)
При Р = const (изобарный процесс)
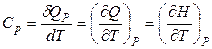 . (2.39)
. (2.39)
Следует помнить, что δQ можно приравнять к dU, если система может выполнять только работу расширения.
При V = const согласно (2.38) можно записать
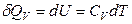 .
.
Таким образом, количество теплоты, необходимое для нагревания 1 моль и n моль вещества от температуры Т 1 до температуры Т 2 при постоянном объеме, можно рассчитать по формулам:
 и
и  . (2.40)
. (2.40)
Если СV = const (идеальный газ), то
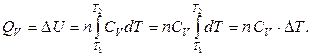
Аналогичным образом, если процесс протекает при P = const, то согласно (2.39) справедливо
 .
.
Количество теплоты, необходимое для нагревания 1 моль и n моль вещества от температуры Т 1 до температуры Т 2 при постоянном давлении, можно рассчитать по формулам:
 и
и  . (2.41)
. (2.41)
Если СP = const (идеальный газ), то
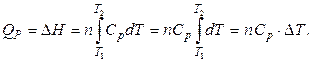
Теплоемкость при постоянном давлении Ср больше, чем теплоемкость при постоянном объеме СV (кроме некоторых веществ с аномальным изменением объема с температурой: например, для жидкой воды при 4 оС СР = СV). При нагревании при постоянном давлении часть теплоты идет на производство работы расширения, а часть на увеличение внутренней энергии тела; при нагревании же при постоянном объеме вся теплота расходуется на увеличение внутренней энергии. Так, при повышении температуры 1 моль идеального газа на 1 К при постоянном давлении выполняется работа расширения
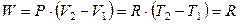 .
.
Следовательно, разность теплоемкостей СР и СV идеального газа равна
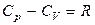 . (2.42)
. (2.42)
Последнее соотношение известно как уравнение Майера.
Найдем связь между Сp и СV для любых систем, которые могут совершать только работу расширения. Согласно первому закону термодинамики
 .
.
Внутренняя энергия является функцией внешних параметров и температуры. Для простой системы 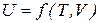 , тогда
, тогда
 ,
,
 ,
,
 . (2.43)
. (2.43)
Величина dV / dT (изменение объема с изменением температуры) представляет собой отношение приращений независимых переменных, то есть величина неопределенная, если не указать характер процесса, при котором происходит теплообмен.
Если процесс изохорный (V = const), то dV = 0, dV / dT = 0 и
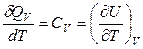 . (2.44)
. (2.44)
Если процесс изобарный (P = const), то
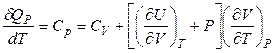 . (2.45)
. (2.45)
Следовательно, для любых простых систем справедливо:
 . (2.46)
. (2.46)
Выражение справа является величиной положительной и, таким образом, изобарная теплоемкость всегда больше изохорной:
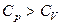 .
.
Для идеальных газов выполняется закон Джоуля (внутренняя энергия идеального газа зависит только от температуры – строго докажем при рассмотрении второго закона термодинамики):
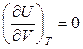 .
.
Поскольку для 1 моля идеального газа РV = RT, то
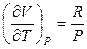 ,
,
 (уравнение Майера).
(уравнение Майера).
Для реальных газов
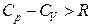 ;
;
причем чем выше давление газа, тем больше будет разность теплоемкостей отличаться от R.
С повышением температуры разность теплоемкостей для реальных газов, жидкостей и твердых тел (Сp – СV) увеличивается, а при Т → 0 К эта разность, как и сами теплоемкости Сp и СV, стремятся к нулю. Для кристаллических тел при обычной температуре (300 К) разность (Сp – СV) < R и составляет величину порядка 1 – 2 Дж/(моль К), а при температурах плавления Сp / CV ≈ 1,25. Для жидкостей различие Сp и СV больше, чем для твердых тел, и зависит от природы жидкостей.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1938; Нарушение авторских прав?; Мы поможем в написании вашей работы!