
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Калорические коэффициенты. Энтальпия
|
|
|
|
Внутренняя энергия простой закрытой системы (система может выполнять только работу расширения) является функцией двух независимых переменных (параметров состояния):
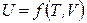 ,
, 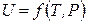 ,
,  .
.
Если независимыми переменными выбрать Т и V, то полный дифференциал U запишется
 . (2.23)
. (2.23)
Подставив значение dU в уравнение первого закона термодинамики
 ,
,
получим
 . (2.24)
. (2.24)
Коэффициенты при независимых переменных в уравнении (2.24) обозначают символами
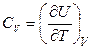 и
и 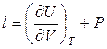 ,
,
тогда
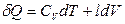 . (2.25)
. (2.25)
Следовательно, если рассматривать теплоту как функцию температуры и объема, получим:
 ,
,  . (2.26)
. (2.26)
Величины (∂Q / ∂V) T и (∂Q / ∂T) V определяются через функцию процесса Q, поэтому без указания конкретных условий проведения процесса их нельзя считать свойствами системы.
Первую из них – (∂Q / ∂V) T – называют теплотой изотермического расширения; ее размерность совпадает с размерностью давления, и она складывается из внешнего давления Р и члена (∂U / ∂V) T, который отражает взаимное притяжение молекул и может быть назван внутренним давлением. Этот член мал для реальных газов и очень велик (по сравнению с обычным внешним давлением) для веществ в конденсированном состоянии.
Величина (∂Q / ∂T) V в соответствии с (2.26) есть теплоемкость при постоянном объеме СV. Из уравнений (2.23) и (2.26) получим
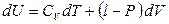 (2.27)
(2.27)
где  – внутреннее давление.
– внутреннее давление.
Как было показано в разделе 2.4, теплота изохорного процесса равна изменению внутренней энергии. Введем новую функцию состояния, изменение которой равно теплоте изобарного процесса.
Определением этой функции служит тождество:
 , (2.28)
, (2.28)
которое легко получить из первого закона термодинамики в виде

при условии, что работа расширения совершается при постоянном давлении:
 . (2.29)
. (2.29)
Любая комбинация свойств (функций состояния) является также свойством системы. Поэтому, согласно (2.29), теплота процесса, протекающего при постоянном давлении, равняется изменению функции состояния – энтальпии:
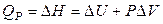 . (2.30)
. (2.30)
Соотношения (2.29) и (2.30) служат обоснованием основного закона термохимии – закона Гесса.
Из определения энтальпии
H = U + PV
и уравнения первого закона термодинамики для простой системы
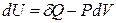
следует, что
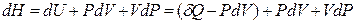 ,
,
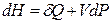 . (2.31)
. (2.31)
Рассматривая Н как функцию независимых переменных Т и Р
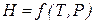 ,
,
получим выражение для дифференциала энтальпии:
 . (2.32)
. (2.32)
Отсюда получаем
 . (2.33)
. (2.33)
Коэффициенты при независимых переменных в уравнении (2.33) обозначают символами
 и
и  .
.
Тогда
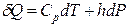 . (2.34)
. (2.34)
Следовательно, если рассматривать теплоту как функцию температуры и давления, получим:
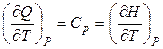 и
и  . (2.35)
. (2.35)
Величина (∂Q / ∂T) P в соответствии с (2.35) есть теплоемкость при постоянном давлении Ср. Величину (∂Q / ∂Р) T называют теплотой изотермического сжатия. Из уравнений (2.32) и (2.35) получим
 . (2.36)
. (2.36)
Величины l, СV, Cр, h называются калорическими коэффициентами. Коэффициенты СV и l определяют зависимость внутренней энергии системы от температуры и объема; а коэффициенты Ср и h – энтальпии от температуры и давления. Теплоемкости Ср и СV, введенные первоначально как эмпирические коэффициенты, оказались важнейшими термодинамическими параметрами: с их помощью вычисляют изменение термодинамических функций с изменением температуры.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3025; Нарушение авторских прав?; Мы поможем в написании вашей работы!