
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Воднеподібні атоми в квантовій механіці. Квантові числа
|
|
|
|
7.6.1. З врахуванням виразу (7.3) для потенціальної енергії електрона в кулонівському полі ядра воднеподібного атома, стаціонарне рівняння Шрьодінгера набуде вигляду
 . (7.45)
. (7.45)
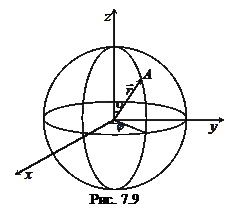 Оскільки кулонівське поле володіє центральною симетрією, то зручно перейти до сферичних координат (рис. 7.9), де положення довільної точки А описується трьома координатами
Оскільки кулонівське поле володіє центральною симетрією, то зручно перейти до сферичних координат (рис. 7.9), де положення довільної точки А описується трьома координатами 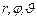 . В цьому випадку рівняння Шредінгера набуває вигляду, складнішого від (7.45), але з’являється можливість представити хвильову функцію як добуток радіальної функції R (r) і кутової
. В цьому випадку рівняння Шредінгера набуває вигляду, складнішого від (7.45), але з’являється можливість представити хвильову функцію як добуток радіальної функції R (r) і кутової  , тобто провести розділення змінних:
, тобто провести розділення змінних:
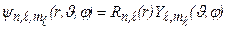 . (7.46)
. (7.46)
Стандартні вимоги як до хвильової функції в цілому, так і до окремих складових забезпечуються лише при певних, дискретних значеннях не тільки енергії електрона, але і квадрату моменту імпульсу його орбітального руху 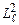 , а також проекції цього моменту
, а також проекції цього моменту 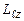 на вибраний напрямок (вісь z). Квантування вказаних характеристик визначається трьома квантовими числами: головним n, орбітальним (азимутальним)
на вибраний напрямок (вісь z). Квантування вказаних характеристик визначається трьома квантовими числами: головним n, орбітальним (азимутальним) 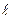 та магнітним
та магнітним  наступним чином:
наступним чином:
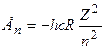 , (7.47)
, (7.47)
де n =1,2,3,…, тобто співпадає з (7.8) для борівського воднеподібного атома;
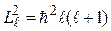 , (7.48)
, (7.48)
де 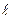 = 0,1,2,…, (n- 1);
= 0,1,2,…, (n- 1);
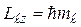 , (7.49)
, (7.49)
де 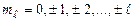 .
.
 Магнітне квантове число вказує на просторове квантування моменту імпульсу електрона: вектор моменту імпульсу електрона може мати лише такі орієнтації в просторі, що його проекції на вибрану вісь z (яка задається, як правило, напрямком магнітного поля) кратні
Магнітне квантове число вказує на просторове квантування моменту імпульсу електрона: вектор моменту імпульсу електрона може мати лише такі орієнтації в просторі, що його проекції на вибрану вісь z (яка задається, як правило, напрямком магнітного поля) кратні 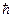 (рис. 7.10).
(рис. 7.10).
Оскільки енергія електрона 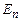 визначається лише головним квантовим числом n, а хвильова функція
визначається лише головним квантовим числом n, а хвильова функція  – усіма квантовими числами, то декільком станам з різними
– усіма квантовими числами, то декільком станам з різними 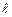 та
та 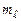 відповідає одне значення енергії. Така ситуація називається квантовомеханічним виродженням. Наприклад, енергія
відповідає одне значення енергії. Така ситуація називається квантовомеханічним виродженням. Наприклад, енергія 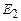 реалізується в чотирьох станах з хвильовими функціями
реалізується в чотирьох станах з хвильовими функціями 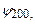
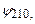
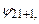
 . В загальному, кратність виродження дорівнює
. В загальному, кратність виродження дорівнює  . Для ілюстрації приведемо вирази для радіальних і кутових функцій в декількох станах:
. Для ілюстрації приведемо вирази для радіальних і кутових функцій в декількох станах:
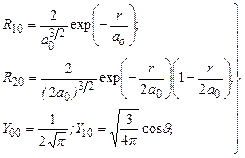 (7.50)
(7.50)
де 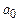 – борівський радіус.
– борівський радіус.
Для основного стану (n = 1) хвильова функція має вигляд
 .(7.51)
.(7.51)
Імовірність знайти електрон в сферичному шарі товщиною dr, тобто в елементарному об’ємі 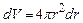 , становить
, становить

а в шарі одиничної товщини –
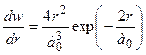 . (7.52)
. (7.52)
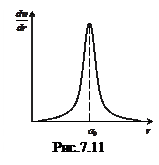
Як видно з рис. 7.11, залежність 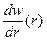 володіє різким максимумом при r = а 0. Отже, борівська орбіта в квантовій механіці може інтерпретуватись як геометричне місце точок, де імовірність перебування електрона – максимальна. Але, оскільки заряд електрона “розмазаний” по усьому атомі
володіє різким максимумом при r = а 0. Отже, борівська орбіта в квантовій механіці може інтерпретуватись як геометричне місце точок, де імовірність перебування електрона – максимальна. Але, оскільки заряд електрона “розмазаний” по усьому атомі  , то в квантовій механіці, у відповідності зі співвідношенням невизначеностей Гайзенберга, поняття орбіти (траєкторії) електрона втрачає зміст.
, то в квантовій механіці, у відповідності зі співвідношенням невизначеностей Гайзенберга, поняття орбіти (траєкторії) електрона втрачає зміст.
7.6.2. Стани електрона з різними значеннями орбітального квантового числа 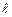 прийнято позначати наступним чином:
прийнято позначати наступним чином:
| . | |||||
| Стан | s | p | d | f | g |
Тому енергетичні рівні з різними n реалізуються наступними станами:
| n = 1 – | стан | 1 s; | |||
| n = 2 – | стани | 2 s, | 2 p; | ||
| n = 3 – | стани | 3 s, | 3 p, | 3 d; | |
| n = 4 – | стани | 4 s, | 4 p, | 4 d, | 4 f. |
Стан 1 s є основним, усі інші стани – збуджені. Час життя електрона в збудженому стані складає ~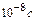 .
.
 Енергетична діаграма квантовомеханічного атома водню має вигляд (рис.7.12), який дещо відрізняється від діаграми борівського атома (рис.7.4). Як і раніше, квантова механіка не накладає жодного обмеження на зміну головного квантового числа. В цей же час зміна
Енергетична діаграма квантовомеханічного атома водню має вигляд (рис.7.12), який дещо відрізняється від діаграми борівського атома (рис.7.4). Як і раніше, квантова механіка не накладає жодного обмеження на зміну головного квантового числа. В цей же час зміна 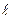 і
і 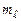 регламентується правилами відбору
регламентується правилами відбору
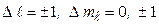 . (7.53)
. (7.53)
Друге правило відбору тут не проявляється, але стає важливим, коли випромінюючі атоми перебувають в магнітному полі.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 723; Нарушение авторских прав?; Мы поможем в написании вашей работы!