
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Парциальные молярные величины
Пусть состояние простой открытой системы и ее масса задается с помощью набора переменных T, P, n 1, n 2, …, nk. Например, если
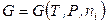 ,
, 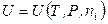 ,
, 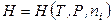 ,
, 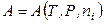 ,
,
то
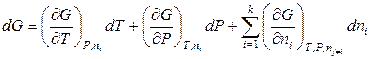 , (6.31)
, (6.31)
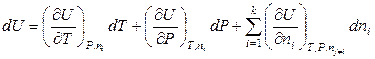 , (6.32)
, (6.32)
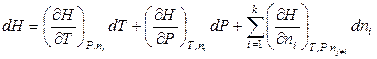 , (6.33)
, (6.33)
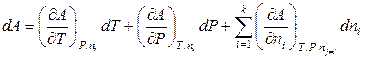 . (6.34)
. (6.34)
Для энергии Гиббса многокомпонентной системы выражение (6.31), как уже было показано в разделе 6.2, преобразуется к виду
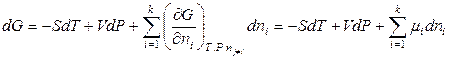 , (6.35)
, (6.35)
а в изобарно-изотермических условиях справедливо выражение
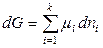 .
.
В общем случае, если Ф – экстенсивная термодинамическая величина (U, Н, F, G, S, V, CP, CV и др.) и
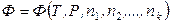 ,
,
то можно определить парциальную молярную величину соотношением
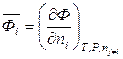 . (6.36)
. (6.36)
Итак, парциальная молярная величина i-го компонента представляет собой частную производную от экстенсивного свойства системы по количеству i-го компонента при постоянных температуре, давлении и массах остальных компонентов (характеризует изменение функции Ф при добавлении к бесконечно большому количеству системы 1 моля i -го компонента). Следует отметить, что в некоторых учебниках и монографиях применяется термин «парциальная мольная величина», что не соответствует современным требованиям ИЮПАК.
Для чистого вещества (xi = 1) парциальная молярная величина обращается в молярную величину для индивидуального компонента:
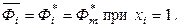
Для многокомпонентных реальных систем парциальные молярные величины i -х компонентов не равны молярным величинам индивидуальных веществ, например:
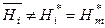 ,
, 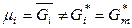 ,
, 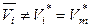 .
.
С учетом введения новой величины, соотношения (6.31) – (6.34) в изобарно-изотермических условиях (P, T = const) принимают вид:
 , (6.37)
, (6.37)
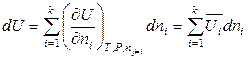 , (6.38)
, (6.38)
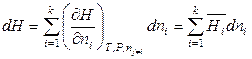 , (6.39)
, (6.39)
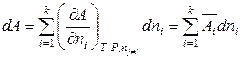 . (6.40)
. (6.40)
Аналогичные соотношения справедливы и для других экстенсивных величин при P, T = const, например:
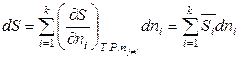 . (6.41)
. (6.41)
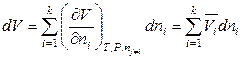 . (6.42)
. (6.42)
Итак, в общем случае для экстенсивной термодинамической величины в изобарно-изотермических условиях выполняется соотношение
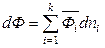 . (6.43)
. (6.43)
Для энергии Гиббса многокомпонентной системы в изобарно-изо-термических условиях, когда
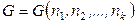 ,
,
согласно определениям химического потенциала и парциальной молярной величины можно записать:
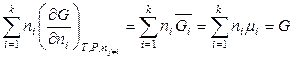 . (6.44)
. (6.44)
Аналогичные выражения (по теореме Эйлера для однородных функций) справедливы и для других экстенсивных термодинамических свойств при P, T = const (первое уравнение Гиббса-Дюгема):
 ,
, 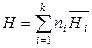 ,
, 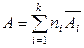 ,
,
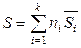 ,
, 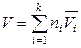 ,
, 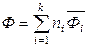 . (6.45)
. (6.45)
В расчете на 1 моль раствора (при делении приведенных выражений на суммарное количество молей всех компонентов) справедливо:
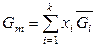 ,
, 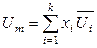 ,
, 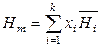 ,
, 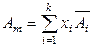 ,
,
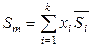 ,
, 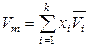 ,
, 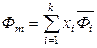 . (6.46)
. (6.46)
Отметим, что согласно определениям химический потенциал i-го компонента есть парциальная молярная энергия Гиббса i-го компонента:
 .
.
Несмотря на то, что химический потенциал может быть определен из нескольких соотношений (6.23):
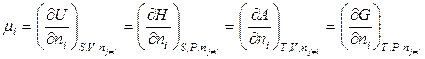 ,
,
только парциальная молярная энергия Гиббса является химическим потенциалом; другие парциальные величины нельзя отождествлять с химическим потенциалом.
Парциальные молярные величины не следует путать и с соответствующими интегральными величинами. Парциальные величины отражают изменение интегрального свойства (определяют вклад данного компонента в общее интегральное свойство системы) и могут принимать значения, нереальные для интегральных величин (например, парциальные молярные объемы могут быть отрицательными и увеличиваться с ростом давления).
Поскольку
 ,
,
то второе уравнение Гиббса-Дюгема, полученое для химических потенциалов, будет выполняться и для других парциальных молярных величин, например:
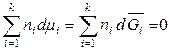 ,
, 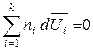 ,
, 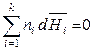 ,
,
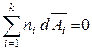 ,
, 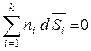 ,
, 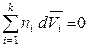 . (6.47)
. (6.47)
Докажем это утверждение. Если Ф – экстенсивная термодинамическая величина и
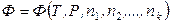 ,
,
то при T, P = const
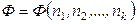
и полный дифференциал Ф запишется как
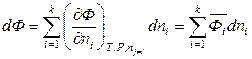 . (6.48)
. (6.48)
С другой стороны, экстенсивная величина Ф является однородной функцией первого порядка относительно чисел молей компонентов и по теореме Эйлера равна
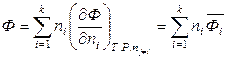 . (6.49)
. (6.49)
Тогда
 . (6.50)
. (6.50)
Сравнивая выражения (6.48) и (6.50), получаем обобщенное второе уравнение Гиббса-Дюгема:
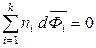 . (6.51)
. (6.51)
Парциальные молярные величины являются интенсивными параметрами: они зависят не от общего количества, а от относительных количеств всех компонентов (от состава) системы. Парциальные молярные величины определяются также Т и Р.
Парциальные молярные величины в термодинамике растворов имеют такое же значение, как и интегральные молярные величины в термодинамике индивидуальных веществ. Поэтому для компонента в растворе справедливы те же термодинамические соотношения, что и для чистого вещества. Рассмотрим, например, уравнение
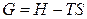 ,
,
где G, H и S относятся к произвольному количеству многокомпонентной системы. При постоянных температуре и давлении справедливо
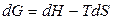 .
.
Продифференцируем обе части данного выражения по dni (числу молей i -го компонента) при условии постоянства давления, температуры и чисел молей всех остальных компонентов системы:
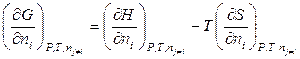 , (6.52)
, (6.52)
или, с учетом определения парциальной молярной величины (6.36)
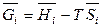 . (6.53)
. (6.53)
Итак, соотношения между парциальными молярными величинами такие же, как и термодинамические соотношения для чистых компонентов. Например,
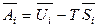 ,
,
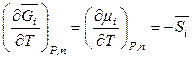 ,
,
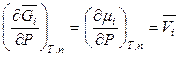 ,
,
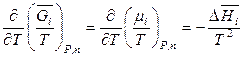 .
.
Для 1 моль раствора обобщенное уравнение Гиббса-Дюгема (6.51) запишется следующим образом:
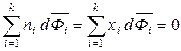 , (6.54)
, (6.54)
где xi – мольная доля i -го компонента. Интегрирование уравнения (6.54) при постоянных температуре и давлении позволяет найти зависимость парциальных молярных величин от состава.
Для бинарного раствора в изобарно-изотермических условиях (Р, Т = const), выбрав в качестве независимой переменной x 2, получим:
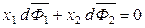 ,
,
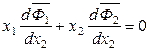 ,
,
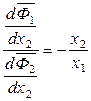 . (6.55)
. (6.55)
Из уравнения (6.55) следует, что производные 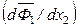 и
и 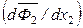 всегда имеют противоположные знаки. Если x 1 = x 2 = 0,5, то
всегда имеют противоположные знаки. Если x 1 = x 2 = 0,5, то
 .
.
Наклоны кривых 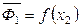 и
и 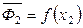 отличаются только по знаку: если на одной кривой есть минимум, то на другой кривой при том же составе будет максимум.
отличаются только по знаку: если на одной кривой есть минимум, то на другой кривой при том же составе будет максимум.
|
|
Дата добавления: 2014-01-04; Просмотров: 1998; Нарушение авторских прав?; Мы поможем в написании вашей работы!