
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля
|
|
|
|
Давление насыщенного пара растворителя над раствором.
В паре над жидким раствором обычно содержатся все компоненты раствора и давление насыщенного пара равно сумме парциальных давлений компонентов:
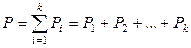 ,
,
где k – число компонентов раствора. При относительно невысоких давлениях насыщенного пара (до нескольких атм) газообразную фазу можно рассматривать как идеальную газовую смесь: насыщенный пар описывается уравнением состояния идеального газа и выполняется закон Дальтона. В некоторых случаях отдельные компоненты могут быть нелетучи при данной температуре и отсутствовать в паре. Как общее давление насыщенного пара, так и парциальные давления компонентов в паре над раствором зависят от температуры и состава жидкого раствора.
Система «насыщенный пар – жидкий раствор» является равновесной, поэтому в изобарно-изотермических условиях (Р, Т = const) химические потенциалы i -го компонента в жидком растворе и паре одинаковы:
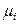 (р-р) =
(р-р) = 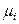 (пар).
(пар).
Для растворителя справедливо:
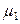 (р-р) =
(р-р) = 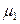 (пар) =
(пар) = 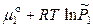 , (8.1)
, (8.1)
где 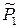 – относительное парциальное давление (насыщенного) пара растворителя над раствором. Чистый жидкий растворитель, взятый при тех же условиях, что и раствор, также будет находиться в равновесии с находящимся над ним насыщенным паром:
– относительное парциальное давление (насыщенного) пара растворителя над раствором. Чистый жидкий растворитель, взятый при тех же условиях, что и раствор, также будет находиться в равновесии с находящимся над ним насыщенным паром:
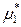 (ж) =
(ж) = 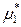 (пар) =
(пар) = 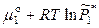 , (8.2)
, (8.2)
где 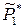 – относительное давление насыщенного пара над чистым растворителем. Химический потенциал растворителя в жидком растворе меньше химического потенциала чистого жидкого растворителя
– относительное давление насыщенного пара над чистым растворителем. Химический потенциал растворителя в жидком растворе меньше химического потенциала чистого жидкого растворителя
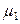 (р-р) <
(р-р) < 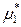 (ж),
(ж),
поскольку в противном случае раствор не образуется (вещество в гетерогенной многокомпонентной системе переходит из фазы с большим химическим потенциалом в фазу с меньшим химическим потенциалом). Тогда, согласно выражениям (8.1) и (8.2), давление насыщенного пара растворителя над раствором всегда меньше давления насыщенного пара над чистым растворителем (при одинаковых условиях):
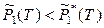 ,
, 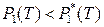 .
.
При постоянной температуре понижение давления насыщенного пара растворителя над раствором зависит от состава раствора (концентрации растворителя). В 1886 году Рауль показал, что относительное понижение парциального давления пара растворителя над бинарным раствором равно мольной доле растворенного вещества:
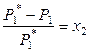 , (8.3)
, (8.3)
где х 2 – мольная доля растворенного вещества. Выражение (8.3) называют законом Рауля.
Растворы, подчиняющиеся закону Рауля во всей области концентраций (0 ≤ x 1 ≤ 1) и при любых температурах, называются идеальными (совершенными) растворами. Такие растворы могут образовывать компоненты, взаимодействие частиц которых в растворе такое же, как и взаимодействие частиц в чистых веществах (растворы изотопов; гомологов, например: бензол – толуол, гексан – октан).
Поскольку для бинарного раствора х 1 + х 2 = 1, то выражение (8.3) можно преобразовать:
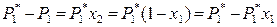 ,
,
где х 1 – мольная доля растворителя в жидком растворе. Следовательно,
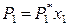 . (8.4)
. (8.4)
Поскольку деление компонентов на растворитель и растворенные вещества условно, то для любого i-го компонента идеального жидкого раствора можно записать:
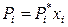 , (8.5)
, (8.5)
то есть парциальное давление пара i -го компонента над идеальным жидким раствором прямо пропорционально его мольной доле в растворе.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 413; Нарушение авторских прав?; Мы поможем в написании вашей работы!