
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В системах с ограниченной взаимной растворимостью жидкостей
|
|
|
|
До сих пор рассматривались полностью (во всей области концентраций, при любых Т и р) взаиморастворимые жидкости (неограниченно смешивающиеся жидкости). Однако на практике не менее часто приходится иметь дело с жидкостями, взаиморастворимыми в ограниченных пределах концентраций и температур (ограниченно смешивающиеся жидкости), или с жидкостями, практически полностью не растворимыми друг в друге (практически несмешивающиеся жидкости).
Для некоторых растворов жидкостей в жидкостях при определенных условиях положительное отклонение от закона Рауля превышает некоторую критическую величину, в результате чего гомогенный раствор распадается на две равновесные жидкие фазы разного состава. Это явление и называется ограниченной взаимной растворимостью жидкостей.
8.13.1. Равновесие «жидкость – жидкость» в системах с ограниченной взаимной растворимостью жидкостей.
Если смешивать две жидкости с ограниченной растворимостью, то в некотором интервале температур и концентраций они будут неограниченно смешиваться друг с другом с образованием одной гомогенной фазы (раствора). В других интервалах температур и концентраций система будет распадаться на две гомогенные фазы, находящиеся в равновесии: раствор первого компонента во втором и второго компонента в первом. Система в целом гетерогенна, при неизменной температуре состав каждого из равновесных слоев остается постоянным.
Температура, выше или ниже которой имеет место неограниченная взаимная растворимость компонентов, называется критической температурой растворения. (Под критической температурой растворения понимают ту температуру, при которой составы двух равновесных жидких фаз одинаковы).
Для изображения зависимости взаимной растворимости жидкостей от температуры при постоянном давлении строят диаграммы состояния в координатах «температура – состав» (диаграммы растворимости).
Существуют следующие виды систем с ограниченной взаимной растворимостью жидкостей:
1). Системы с верхней критической температурой растворения (фенол – вода, анилин – вода); принципиальная диаграмма растворимости которых представлена на рис. 8.9.
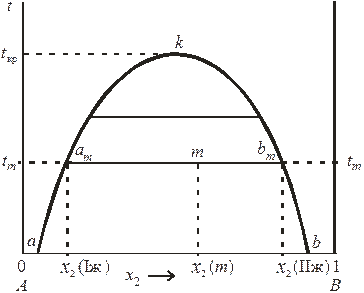
Рис. 8.9. Диаграмма состояния системы ограниченно смешивающихся
жидкостей с верхней критической температурой растворения.
На рассматриваемой диаграмме кривая akb, называемая кривой расслоения (ликвации), разделяет области существования гетерогенных (под кривой расслоения) и гомогенных (над кривой расслоения) систем. Составы равновесных жидких фаз находятся по правилу соединительной прямой: фигуративные точки, изображающие состав всей системы и составы отдельных равновесных фаз, лежат на одной прямой, называемой нодой. Так, например, система состава x 2(m), изображенная на диаграмме точкой m, при температуре tm распадается на две равновесные фазы am и bm составов x 2(Iж) и x 2(IIж). Характерной особенностью расслаивающихся систем является то, что в гетерогенной области при заданной температуре с изменением состава всей системы составы отдельных фаз остаются постоянными, меняется только их количественное соотношение (определяется по правилу рычага).
Повышение температуры ведет к увеличению взаимной растворимости жидкостей (составы жидких фаз сближаются), так что при некоторой температуре достигается полная взаимная растворимость жидкостей: например при t кр = 168 оС для системы вода – анилин и при t кр = 65,8 оС для системы фенол – вода (критические температуры растворения).
2). Системы с нижней критической температурой растворения (триэтиламин – вода, 2,4,6‑триметилпиридин – вода). Повышение температуры в таких системах приводит к уменьшению взаимной растворимости жидкостей. При температурах ниже критической температуры растворения наблюдается полная взаимная растворимость жидкостей, выше – система расслаивается.
3). Системы с верхней и нижней критическими температурами растворения (вода – никотин). Между двумя критическими температурами существует область, в которой система гетерогенна. Например, для системы никотин – вода критические температуры растворения равны 208 оС и 61 оС.
8.13.2. Равновесие «пар – жидкий раствор» в системах с ограниченной взаимной растворимостью жидкостей.
Если система образована из двух летучих ограниченно смешивающихся жидкостей, то пар над такой системой будет содержать оба компонента и находиться в равновесии либо с одной (гомогенная область), либо с каждой из жидких фаз (гетерогенная область). Однако если в гетерогенной системе две фазы порознь находятся в равновесии с третьей фазой, то они равновесны и между собой. Тогда
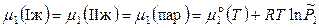 , (8.68)
, (8.68)
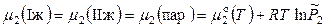 , (8.69)
, (8.69)
и при постоянной температуре парциальное давление одного и того же компонента над обеими равновесными жидкими фазами одинаково:
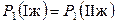 и
и 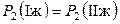 .
.
Поскольку общее давление пара равно сумме парциальных давлений компонентов
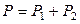 ,
,
то при равновесии над обеими жидкими фазами общее давление пара одинаково.
Далее, так как в изотермических условиях для гетерогенной области с изменением состава расслаивающейся системы составы равновесных жидких фаз не изменяются (рис. 8.9), то при T = const с изменением состава расслаивающейся системы парциальные давления отдельных компонентов и общее давление пара остаются постоянными.
В качестве примера рассмотрим системы, компоненты которых обладают близкими значениями давления насыщенного пара и малой взаимной растворимостью жидкостей (анилин – вода, бензол – вода, бутиловый спирт – вода). Для таких систем при T = const выполняется соотношение
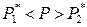 .
.
Диаграмма состояния указанной системы представлена на рис. 8.10.
Как видно из рис. 8.10, рассматриваемая система характеризуется большими положительными отклонениями от закона Рауля. Из соотношений для области расслоения
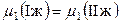 и
и 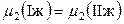 ,
,
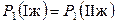 и
и 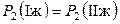 ,
,
следует, что активности каждого их компонентов в двух равновесных жидких растворах при постоянной температуре должны быть одинаковы:
 и
и 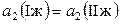 . (8.70)
. (8.70)
Например,
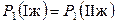 ,
, 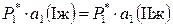 ,
,  ;
;
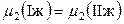 ,
, 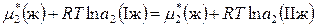 ,
, 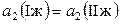 .
.
Тогда, например, для второго компонента можно записать
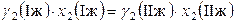 ,
, 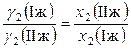 . (8.71)
. (8.71)
Коэффициенты активности данного компонента в равновесных жидких фазах обратно пропорциональны его мольным долям в этих фазах. (Чем меньше мольная доля компонента в жидкой фазе, тем больше его коэффициент активности.)
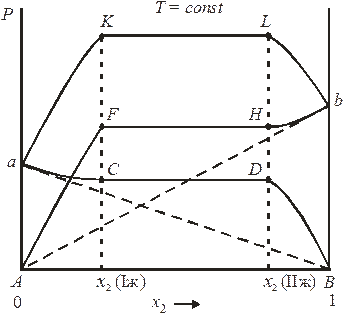
Рис. 8.10. Зависимость общего и парциальных давлений пара от состава
системы в случае ограниченной взаимной растворимости жидкостей
при T = const, если 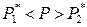 :
:
область составов от x 2(Iж) до x 2(IIж) – область расслоения;
кривая aB – P 1 = f (x) по закону Рауля; кривая Аb – P 2 = f (x) по закону Рауля;
кривая аCDB – P 1 = f (x) в системе; кривая АFHb – P 2 = f (x) в системе;
кривая aKLb – P = f (x) – зависимость общего давления пара от состава.
8.14. Равновесие «пар – жидкость»
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6842; Нарушение авторских прав?; Мы поможем в написании вашей работы!