
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая коррозия
|
|
|
|
15.3.1 Механизм электрохимической коррозии
Коррозия металла в средах, имеющих ионную проводимость, протекает через анодное окисление металла
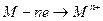 .
.
и катодное восстановление окислителя (Ох)
Ох + пе 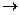 Red.
Red.
Окислителями при коррозии служат молекулы кислорода О2, хлора С12, ионы Н+, Fe3+, NO3" и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:
в нейтральной или щелочной среде
О2 + 2Н2О + 4е 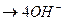 ,
,
в кислой среде
О2 + 4Н+ + 4е 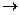 2Н2О,
2Н2О,
и выделение водорода
2Н+ + 2е 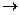 Н2.
Н2.
Коррозия с участием кислорода называется коррозией с поглощением кислорода (коррозия с кислородной деполяризацией) Коррозия с участием ионов водорода называется коррозией с выделением водорода (коррозией с водородной деполяризацией)
Кроме анодных и катодных реакций при электрохимической коррозии происходит движение электронов в металле и ионов электролите. Электролитами могут быть растворы солей, кислот и оснований, морская вода, почвенная вода, вода атмосферы, содержащая С02, SO2, O2 и другие газы.
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например, взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций
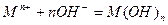 .
.
Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах.
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из коррозирующего металла, а двигаются внутри металла.
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция

|
Катодная реакция – восстановление атмосферного кислорода:

|
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
| 2Fe + O2 + 4H+ → 2FeO + 2H2O. |
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение концентрации ионов водорода pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При pH = 9…10 коррозия железа практически прекращается. Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+. Вторая стадия коррозии соответствует реакции образования гидратированного оксида железа (ржавчины) Fe2O3∙nH2O:
| 4Fe2+ + O2 + 4H2O + xH2O = 2Fe2O3∙xH2O + 8H+. |
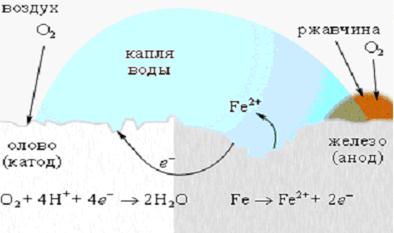
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рисунок 4).

|
| Рисунок 15.3 -Коррозия железа кислородом воздуха, растворенным в воде. |
|
| Рисунок 15.4 - Коррозия «белой жести» |
Причинами энергетической неоднородности поверхности и сплава могут быть неоднородность сплава по химическому и фазовому составам, наличие примесей в металле, пленок на его поверхности и др. На поверхности металла могут быть участки, на которых катодные реакции протекают быстрее (катализируются), чем на других участках. Поэтому катодный процесс в основном будет протекать на участках, которые называются катодными. Наличие участков, на которых катодные реакции протекают быстрее, увеличивает скорость коррозионного процесса. На других участках будет протекать в основном растворение металла и поэтому они называются анодными. Катодные и анодные участки чередуются и имеют очень малые размеры, т. е. речь идет о микроанодах и микрокатодах и соответственно о коррозионных микроэлементах. Таким образом, при наличии энергетической неоднородности поверхности металла коррозионный процесс заключается в работе огромного числа коррозионных микроэлементов. Коррозионный элемент в отличие от гальванического является короткозамкнутым микроэлементом.
Разрушение металла по механизму работы короткозамкнутых элементов — не единственный путь электрохимической коррозии. Иногда энергетическая неоднородность металлов невелика и отсутствуют участки, катализирующие катодные реакции. Тогда как катодные, так и анодные процессы идут по всей поверхности металла. Коррозионный процесс в отсутствие участков, катализирующих катодные реакции, протекает медленнее, чем при наличии катодных катализаторов. Так, например, цинк высокой степени чистоты растворяется в растворе серной кислоты значительно медленнее, чем технический цинк, содержащий примеси, которые катализируют реакцию выделения водорода.
15.3.2 Скорость электрохимической коррозии
Разность потенциалов металла и окислителя определяют возможность коррозии. Более важной характеристикой служит скорость коррозии, выражаемая через потери металла в единицу времени. Скорость коррозии может быть также выражена по закону Фарадея через ток или плотность тока.
Так как электрохимическая коррозия протекает через несколько взаимосвязанных стадий, то скорость ее зависит от скорости самой медленной стадии, называемой лимитирующей (контролирующей) стадией процесса. Все остальные стадии вынуждены иметь скорость равную скорости лимитирующей стадии процесса. Поскольку коррозионные элементы являются короткозамкнутыми микроэлементами движение электронов в металле не может быть лимитирующей стадией процесса. Движение ионов в растворе обычно также не лимитирует процесс коррозии ввиду очень малого расстояния между микроэлементами (исключение составляют растворы с очень малой электрической проводимостью). Следовательно, лимитирующими стадиями могут быть или реакции анодного окисления металла (анодный контроль), или реакции катодного восстановления окислителя (катодный контроль), или те и другие одновременно (смешанный контроль).
Для борьбы с коррозией металла, контролируемой скоростью восстановления кислорода, следует снижать концентрацию кислорода, например, введением восстановителя в раствор или снижением давления кислорода над раствором. Скорость коррозии можно также снизить, изолируя металл от кислорода тем или иным способом. Изменение состава катодных участков мало влияет на коррозию с поглощением кислорода. Поэтому степень чистоты металла обычно не играет существенной роли при коррозии с поглощением кислорода.
Если потенциал металла отрицательнее потенциала водородного электрода, то процесс коррозии протекает как с поглощением кислорода, так и с выделением водорода. Если кислород в системе отсутствует или быстро расходуется в результате коррозии, например, в закрытой системе, то коррозия протекает лишь с выделением водорода.. Однако и при наличии кислорода в системе скорость его восстановления в некоторых случаях мала по сравнению со скоростью выделения водорода. При этом в первом приближении можно пренебречь скоростью коррозии за счет поглощения кислорода и говорить лишь о скорости коррозии с выделением водорода. Ввиду большой подвижности ионов Н+ обычно стадия подвода не лимитирует реакцию катодного выделения водорода. Скорость процесса определяется скоростью собственной реакции восстановления ионов водорода: или соединением атомов водорода в молекулу.
Скорость катодного выделения водорода возрастает с увеличением температуры и концентрации ионов водорода (снижением рН).
Итак, электрохимическая коррозия протекает через сопряженные процессы анодного растворения металла и катодного восстановления окислителя, обычно молекул кислорода или ионов водорода. Возможность протекания при коррозии того или иного катодного процесса определяется его потенциалом. Коррозия с поглощением кислорода лимитируется стадией диффузии кислорода и возрастает с увеличением его концентрации и при перемешивании и зависит от температуры. Коррозия с выделением водорода зависит от природы примесей в металле, от рН и возрастает с увеличением температуры. Некоторые металлы имеют склонность к пассивации вследствие образования защитных слоев.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1069; Нарушение авторских прав?; Мы поможем в написании вашей работы!