
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия и защита металлов
|
|
|
|
Вопросы для самоконтроля
Законы электролиза (М. Фарадей)
1. Весовое количество выделяемого при электролизе вещества пропорционально количеству протекшего через раствор электричества и практически не зависит от других факторов.
2. Равные количества электричества выделяют при электролизе из различных химических соединений эквивалентные количества веществ.
3. Для выделения из раствора электролита одного грамм-эквивалента любого вещества нужно пропустить через раствор 96500 кулонов электричества.
m(x) = ((I • t) / F) • (M(x) / n), (14.10)
где m(x) - количество восстановленного или окисленного вещества, г;
I - сила пропускаемого тока, а;
t - время электролиза, с;
M(x) - молярная масса, г/моль;
n - число приобретенных или отданных в окислительно-восстановительных реакциях электронов;
F = 96500 кул/моль - постоянная Фарадея.
Исходя из этой формулы, можно производить ряд расчетов, связанных с процессом электролиза, например:
1) вычислять количества веществ, выделяемых или разлагаемых определенным количеством электричества;
2) находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение;
3) устанавливать, сколько времени потребуется для выделения определенного количества вещества при заданной силе тока.
1. Как классифицируются химические реакции?
2. Какие вещества называют окислителями?
3. Какие вещества называют восстановителями?
4. Какой процесс называют окислением, а какой восстановлением?
5. Как классифицируются окислительно-восстановительные реакции?
6. Приведите правила определения степеней окисления элементов в соединениях.
7. Как влияет среда на протекание окислительно-восстановительных процессов?
8. Как определить направление окислительно-восстановительной реакции?
9. Что такое электродный потенциал?
10. Что такое стандартные электродные потенциалы металлов?
11. Потенциал какого электрода принимают равным нулю и используют в качестве электрода сравнения при измерении электродных потенциалов различных металлов?
12. От чего зависит электродный потенциал металла?
13. Что называется электролизом?
14. Какой электрод называют катодом, какой – анодом?
15. Какие процессы протекают на аноде, на катоде?
16. Какие металлы можно получить при электролизе расплавов и нельзя получить при электролизе водных растворов их солей?
17. Для каких металлов характер катодных процессов при электролизе растворов и расплавов их солей одинаков?
18. Окисляются ли на аноде анионы оксокислот при электролизе водных растворов соответствующих кислот и образуемых ими солей?
19. Может ли растворяться катод при электролизе?
20. Какие типы анодов вы знаете?
21. Будет ли растворяться при электролизе анод: из железа, графита, платины, меди?
22. Составьте уравнения электролиза расплавов: а) MgCl2, LiOH, CaBr2, Ba(OH)2, NaF и LiH, б) смеси KF и KCl.
23. Определите, могут ли существовать одновременно в водном растворе вещества:
а) азотная кислота (конц.) и сероводород,
б) пероксид водорода и иодоводород,
в) бромат калия и бромоводород,
г) дихромат калия, серная кислота и нитрат калия,
д) перманганат калия и сульфат калия,
е) серная кислота (разб.) и хлороводород,
ж) иодид калия и хлор.
24. Проводится электролиз воды в присутствии: а) NaClO4,KNO3, б) HClO4, HNO3, в) NaOH, LiOH. Составьте уравнения электрохимических реакций.
25. Составьте уравнения электролиза водных растворов: а)MgI2, BaCl2 и KF, б) смеси NaOH b NaCl.
15.1 Определение и классификация коррозионных процессов
Коррозия — это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
Коррозия самопроизвольный процесс и соответственно протекает с уменьшением энергии Гиббса системы. Химическая энергия реакции коррозионного разрушения металлов выделяется в виде теплоты и рассеивается в окружающем пространстве. Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т. п. Безвозвратные потери металлов от коррозии составляют до15% от ежегодного их выпуска. Замена прокорродировавшего котла или конденсатора на большой теплоэлектростанции может нанести энергосистеме существенный ущерб. Кроме того, к убыткам от коррозии можно отнести также стоимость потерянного продукта, например, масла, газа, воды из системы с прокорродированными трубами или антифриза через прокорродировавший радиатор. Выброс природного Газа и других пожаро- и взрывоопасных веществ через отверстия, образованные вследствие коррозии, может привести к пожарам и даже к мощным взрывам с огромными и материальными потерями и даже с человеческими жертвами, как, например, в случае Башкирской трагедии.
В целом потери народного хозяйства от коррозии исчисляются миллиардами рублей ежегодно. Цель борьбы с коррозией — это сохранение ресурсов металлов, мировые запасы которых ограничены. Изучение коррозии и разработка методов защиты металлов от нее представляют теоретический интерес и имеют большое народнохозяйственное значение.
По механизму протекания коррозионного процесса, зависящему; от характера внешней среды, с которой взаимодействует металл, различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию - в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах; б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное Растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах — входных растворах солей, кислот, щелочей, в морской воде; б) в атмосфере любого влажного газа; в) в почве.
Особым видом электрохимической коррозии следует считать коррозию за счет внешнего электрического тока. В качестве пример0й подобного вида разрушений можно привести коррозию трубопроводов с токопроводящими жидкостями, нерастворимых анодов в электрохимических ваннах, подземных металлических сооружений.
Хотя механизм протекания коррозионного процесса в разных условиях различен, по характеру разрушения поверхности металла коррозию можно разделить на равномерную и местную (рисунок 15.1).
Равномерная, иди общая, коррозия распределяется более или менее равномерно по всей поверхности металла, в то время как местная коррозия сосредоточена на отдельных участках и проявляется в виде точек, язв или пятен. Местная коррозия, как правило, более опасна чем равномерная коррозия, так как процесс проникает на большую глубину. Особыми видами коррозии являются межкристаллическая коррозия (коррозия по границам зерен), избирательная коррозия (растворение одного из компонентов сплава) и коррозионное растрескивание (коррозия при одновременном воздействии химических реагентов и высоких механических напряжений). Данные виды коррозии особенно опасны, так как могут привести к быстрому разрушению машины, аппарата или конструкции.
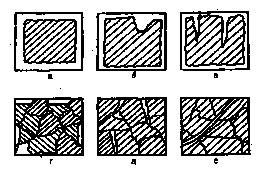
а – равномерное, б – местное, в – точечное, г – избирательное,
д – межкристаллическое, е - транскристаллическое
Рисунок 15.1 – Виды коррозионных разрушений
Скорость коррозии выражают несколькими способами. Наиболее часто пользуются массовым и глубинным показателями коррозии. Первый из них дает потерю массы (в граммах или килограммах) за единицу времени (секунду? час, сутки, год), отнесенную к единице площади (квадратный метр) испытуемого образца. Глубинный показатель коррозии выражается уменьшением толщины металла в единицу времени. Скорость электрохимической коррозии можно также выразить величиной тока, приходящегося на единицу площади металла.
Итак, самопроизвольное разрушение металла (коррозия) приносит большие убытки. Коррозия протекает по различным механизмам и вызывает разные виды разрушений.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1010; Нарушение авторских прав?; Мы поможем в написании вашей работы!