
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Нернста
|
|
|
|
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех параметров:
1) от природы веществ-участников электродного процесса;
2) от концентраций (активностей) этих веществ (или ионов);
3) от температуры системы.
И эта зависимость выражается уравнением Нернста (14.5).
Критерий возможности самопроизвольного протекания электрохимической (окислительно-восстановительной) реакции – отрицательная величина 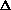 G реакции. В общем случае для реакции
G реакции. В общем случае для реакции
aA + bB ↔ cC + dD
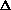 G =
G = 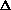 G0 + RT ln([C]c[D]d/[A]a[B]b). (14.3)
G0 + RT ln([C]c[D]d/[A]a[B]b). (14.3)
В положении равновесия 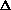 G = 0 и
G = 0 и
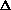 G0 = -RTlnKр. (14.4)
G0 = -RTlnKр. (14.4)
Тогда
E = -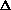 G/nF = (RT/nF)[lnKр - ln([C]c[D]d/[A]a[B]b)],
G/nF = (RT/nF)[lnKр - ln([C]c[D]d/[A]a[B]b)],
E =E0 - (RT/nF) ln([C]c[D]d/[A]a[B]b), (14.5)
где n- число электронов, принимающих участие в полуреакции;
Kр = [C]cравн[D]dравн/[A]aравн[B]bравн - константа равновесия.
Для обычной при электрохимических измерениях стандартной температуры (25 °С = 298 К) при подстановке значений постоянных величин (R=8,31 Дж/(моль ∙ К), F=96500 Кл/грамм-эквивалент) уравнение (1.5) принимает вид:
Е = Е°298 + 0,059 / z ∙ lg(C Oic. / С восст.). (14.6)
Если в качестве электрода используют металл, погруженный в раствор его соли, то рассматриваемая формула примет вид:
Е = Е0298 + 0,059 / z ∙ lg С ок, (14.7)
так как концентрация твердой фазы (металла) принимается равной 1.
ЭДС гальванического элемента определяется как разность потенциалов восстановления электродов, причем от большего потенциала отнимают меньший:
ЭДС = Е1 (катода) - Е2 (анода). (14.8)
В уравнении Нернста, строго говоря, нужно вместо концентраций пользоваться активностями ионов.
Если разность стандартных восстановительных потенциалов невелика (не более 0,3 В), направление окислительно-восстановительной реакции можно изменить, изменяя концентрации веществ и температуру.
Гальванический элемент, составленный из двух одинаковой природы электродов, которые различаются только концентрацией одноименных ионов металла в растворах, называется концентрационным.
Например, схема такого элемента, составленная из двух медных электродов, которые опущены в два раствора сульфата меди с различной молярной концентрацией имеет вид:
Сu CuSO4(10-6 М) | КСl | CuSO4(lM) | Сu.
ЭДС концентрационного элемента можно определить по формуле
ЭДС конц. гальв. эл. = 0,059 / z ∙ lg(Clок. / С2ок.). (14.9)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 431; Нарушение авторских прав?; Мы поможем в написании вашей работы!