
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантово-химическое описание ковалентной связи
|
|
|
|
Объединение атомов в молекулу происходит только тогда, когда их суммарная энергия при образовании связи понижается. В общем случае между атомами действуют силы притяжения (Еприт) и силы отталкивания (Еотт). В случае образования связи кривая зависимости потенциальной энергии атомов от межъядерного расстояния имеет минимум (рис. 3.1). При невозможности образования химической связи между атомами эта кривая совпадает с кривой, отражающей действие сил отталкивания (рис. 3.2). Именно характер изменения кривой потенциальной энергии системы из двух атомов является критерием образования химической связи между ними.
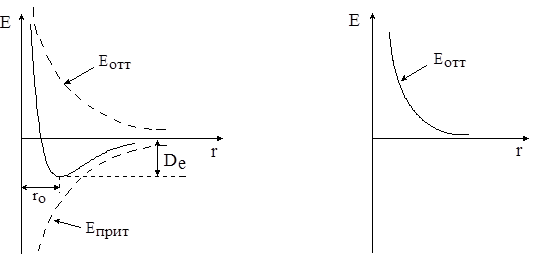
| |
| Рис. 3.1. Кривая потенциальной энергии двухатомной молекулы | Рис. 3.2. Кривая потенциальной энергии системы из двух атомов, не образующих химическую связь |
На рис. 3.1 ro – межъядерное расстояние, отвечающее устойчивому состоянию молекулы; De – электронная энергия диссоциации двухатомной молекулы.
Так или иначе дорога к установлению тех или иных характеристик химической связи лежит через решение соответствующего уравнения Шредингера. Как уже было сказано, для многоэлектронных систем такое решение возможно только в приближённом варианте. Упрощенно идеология решения следующая. Умножают уравнение Шредингера на Ψ:
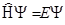 ,
, 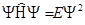 ,
,
интегрируют обе части уравнения по всему объёму и выражают значение полной энергии системы:
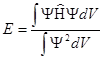
Меняя варианты построения молекулярной Ψ-функции находят условия минимума энергии системы и максимального совпадения экспериментальной и расчётной кривых изменения энергии системы с межъядерным расстоянием.
Таким образом, одной из центральных проблем квантово-химического описания ковалентной связи является способ построения молекулярной Ψ-функции из атомных Ψ-функций. В соответствии с разными подходами к этой проблеме существуют метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Основные положения метода ВС заложены в 1927 г. Гейтлером и Лондоном. Эти исследователи рассматривали химическую связь в простейшей молекуле – молекуле водорода, содержащей ядра а и в, а также электроны 1 и 2 (рис. 3.3).
Рис. 3.3. Молекула Н2 в методе валентных связей
Гейтлер и Лондон допускали движение электронов вокруг обоих ядер. За основу построения молекулярной Ψ-функции для двух электронов в молекуле Н2 авторы взяли атомные функции 1s-состояния. Аналогично тому, как математическая вероятность одновременного осуществления двух независимых событий равна произведению вероятностей для молекулярной Ψ-функции, Гейтлер и Лондон записали два произведения: Ψа(1)Ψв(2) и Ψа(2)Ψв(1), поскольку электроны неразличимы. Авторы сочли хорошим приближением для молекулярной Ψ-функции линейную комбинацию из этих произведений:
Ψ = С1Ψа(1)Ψв(2) + С2Ψа(2)Ψв(1),
где С1 и С2 – постоянные.
Приближённое решение уравнения Шредингера привело к соотношению С12 = С22, следовательно возможны два состояния С1 = С2 и С1 = –С2.
В случае С1 = С2 волновая функция имеет вид:
ΨS = СS[Ψа(1)Ψв(2) + Ψа(2)Ψв(1)]
и называется симметричной, поскольку она безразлична к перестановке координат ядер и электронов. Расчёт с применением этой функции даёт кривую потенциальной энергии, имеющую минимум и сходную с экспериментальной кривой для молекулы Н2. При этом электроны имеют противоположные спины.
В случае С1 = –С2 волновая функция имеет вид:
ΨA = СA[Ψа(1)Ψв(2) – Ψа(2)Ψв(1)]
и называется антисимметричной, поскольку при перестановке координат ядер или электронов функция меняет знак. Расчёт с применением этой функции даёт кривую потенциальной энергии, сходную с кривой, изображенной на рис. 3.2. При этом электроны имеют параллельные спины.
Расчёт, выполненный Гейтлером и Лондоном, показал, что присоединение третьего атома водорода невозможно – это и есть обоснование свойства насыщаемости ковалентной связи (спин третьего электрона обязательно совпадет со спином одного из первых двух электронов!). Таким образом, был сделан важный вывод, что связь образуется только тогда, когда атомы имеют неспаренные электроны.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1076; Нарушение авторских прав?; Мы поможем в написании вашей работы!