
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные положения метода валентных связей сводятся к следующему
|
|
|
|
1. Химическую связь образуют два электрона с противоположными спинами. При этом перекрываются соответствующие электронные орбитали и повышается электронная плотность между ядрами. В первом приближении можно считать, что именно в зоне перекрывания и находится общая электронная пара. Сгусток отрицательного заряда между ядрами притягивает их друг к другу; при определенном расстоянии между ядрами, соответствующем образованию связи между ними, притяжение уравновешивается отталкиванием положительных зарядов ядер. Такова физическая причина образования химической связи.
2. Связь локализована в направлении максимального перекрывания Ψ-функций электронов.
3. Чем сильнее перекрывание, тем прочнее химическая связь. По характеру перекрывания орбиталей обычно выделяют s- и p-связи (рис. 3.4 и 3.5).
Связи, образованные электронными орбиталями, имеющими максимум зоны перекрывания на линии, соединяющей ядра, называются s-связями. На рис. 3.4 представлены s-связи, образованные s- и p-орбиталями.

Рис. 3.4. s-связи, образованные s- и p-орбиталями
Связи, образованные электронными орбиталями, дающими максимумы перекрывания по обе стороны от линии, соединяющей ядра, называются p-связями. На рис. 3.5 представлена p-связь, образованная p-орбиталями.
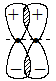
Рис. 3.5. p-связь, образованная p-орбиталями
В подавляющем большинстве случаев p-связи менее прочные, чем s-связи. В кратной связи только одна связь s-типа, все остальные (одна или две) относятся к p-связям.
4. Численное значение валентности атома равно количеству неспаренных электронов, которые есть на внешнем электронном слое в основном состоянии или могут быть в возбуждённом состоянии. Для s- и p-элементов возбуждение электронов возможно только в пределах внешнего электронного слоя. В случае d-элементов к рассмотрению привлекаются и d-электроны предвнешнего слоя, имеющие энергию, близкую к энергии электронов внешнего слоя.
Рассмотрим с этих позиций валентные возможности атомов. Атом водорода имеет единственный (неспаренный) электрон в 1s-оболочке, поэтому он всегда будет одновалентным в соединениях. У атома гелия в той же оболочке два электрона; поскольку в этом случае неспаренных электронов нет и получить их в результате возбуждения невозможно, атом гелия образовывать соединения неспособен.
Атом лития на внешнем слое имеет единственный неспаренный электрон, что обусловливает его одновалентность. В равной степени это же относится ко всем щелочным металлам, атомы которых имеют строение внешнего электронного слоя ns1.
У атома бериллия в основном состоянии неспаренных электронов нет, однако в результате возбуждения есть возможность “перегнать” электрон из 2s-оболочки в 2р-оболочку:

В результате приходим к заключению, что в рамках метода ВС атом бериллия может иметь валентность 0 (тривиальный случай) и 2. Этот вывод справедлив в отношении магния и щелочноземельных металлов.
Имеющий один неспаренный электрон в 2р-оболочке атом бора может быть в соединениях одновалентен; в результате возбуждения число неспаренных электронов может быть увеличено до трёх:

Соответственно максимальная валентность у атома бора равна 3. Валентные возможности 1 и 3 характерны и для Al, Ga, In, Tℓ.
Два неспаренных электрона на 2р-оболочке атома углерода позволяют ему быть двухвалентным, хотя соединений двухвалентного углерода мы не знаем. В результате возбуждения и перевода одного электрона с 2s- на 2р-оболочку появляется возможность реализовать валентность 4:
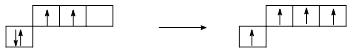
В полной мере сказанное относится и к Si, Ge, Sn, Pb.
Три неспаренных электрона атома азота и невозможность увеличения их числа за счёт возбуждения приводят к заключению, что азот в рамках метода ВС может быть только трёхвалентен:

Расширение валентных возможностей, как уже обсуждалось, возможно за счёт донорно-акцепторного механизма образования связи.
Атом кислорода может быть по методу ВС только лишь двухвалентен
 ,
,
а атом фтора – только одновалентен
 ,
,
что обусловлено отсутствием d-орбиталей во втором слое. Что же касается атома неона, то для него, как и для атома гелия, в рамках представлений метода ВС образование соединений невозможно.
Принципиальное отличие атомов P, As, Sb и Bi от атома азота состоит в том, что внешний электронный слой имеет d-орбитали, что позволяет увеличить за счет возбуждения число неспаренных электронов до пяти:
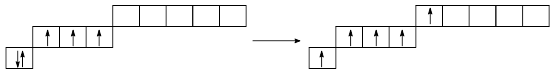 ,
,
Таким образом, валентные возможности этих атомов 3 и 5. Именно поэтому существует соединение PF5, но нет молекулы NF5, а только NF3.
Сходным образом происходит расширение валентных возможностей атомов S, Se, Te по сравнению с атомом кислорода:

Поэтому известны, например, соединения SF4, SF6, но нет ОF4 и ОF6.
Атомы Cℓ, Br, I в отличие от одновалентного фтора имеют валентные возможности 1, 3, 5 и 7:
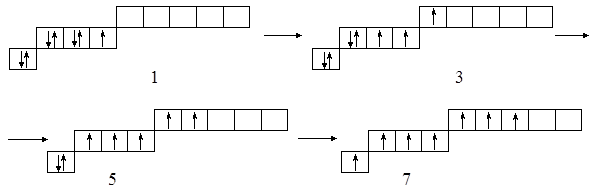
Поэтому, например, у йода со фтором известны соединения IF, IF3, IF5, IF7, а не наоборот.
Наконец, атомы благородных газов, начиная с аргона, согласно методу ВС могут иметь валентные возможности 2, 4, 6, 8. В настоящее время получено сравнительно большое число соединений ксенона указанных валентностей и около десятка соединений криптона, проявляющего валентность 2, 4, 6.
Атомы d-элементов имеют на внешней s-оболочке один или два электрона и несколько (спаренных, неспаренных или частично спаренных) электронов на предвнешней d-оболочке. Напомним, что энергии ns- и (n–1)d-орбиталей при больших значениях n близки. Кроме того, атомы этих элементов характеризуются большим числом пустых орбиталей во внешнем слое. Принимая во внимание сказанное, можно придти к выводу, что атомы d-элементов могут иметь валентности, начиная с 1 или 2, вплоть до суммарного числа внешних электронов. Такая, в некоторой степени неопределенная ситуация с валентностями приводит к тому, что валентность и валентные возможности атомов подменяют понятием “степень окисления”. Это нельзя признать корректным, если вспомнить, что понятие “степень окисления” призвано (и придумано!) ради двух целей: 1) классифицировать химические реакции на окислительно-восстановительные реакции (ОВР) и обменные; 2) упростить процедуру расстановки коэффициентов в ОВР.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 757; Нарушение авторских прав?; Мы поможем в написании вашей работы!