
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Геометрия молекул
|
|
|
|
Метод ВС позволяет изображать схемы перекрывания орбиталей при образовании связей в молекулах и предсказывать валентные углы, т. е. геометрию молекул, поскольку электронные орбитали конкретно ориентированы в пространстве. Например, образование химической связи в молекулах галогеноводородов представляется перекрыванием по s–типу 1s-орбитали атома водорода и np-орбитали атома галогена:

Образование связей в молекулах водородных соединений халькогенов представляется перекрыванием двух взаимно перпендикулярных р-орбиталей с двумя 1s-орбиталями:
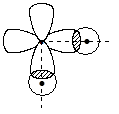
Следовательно, можно ожидать, что валентный угол Н–Э–Н в этих соединениях составляет 90o. В случае молекул H2S, H2Sе, H2Те угол действительно близок к этой величине, а вот для молекулы воды он составляет (экспериментальная величина) 104,5o!
Сходным образом для молекул водородных соединений N, P, As, Sb образование связей – это перекрывание трёх np-орбиталей с тремя 1s-орбиталями атомов Н:
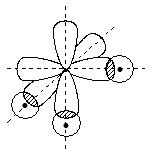
Валентные углы Н–Э–Н должны составлять 90o. Для молекул РH3, AsH3, SbH3 они близки к этой величине, в молекуле же аммиака валентные углы H–N–H составляют 107o.
Из эксперимента известно, что молекула метана симметрична, имеет форму тетраэдра и углы H–С–H составляют 109o28¢. В то же время классический вариант метода ВС не способен объяснить такое устройство молекулы метана. Ведь четырёхвалентный углерод должен давать три связи с углами 90o, а четвертая связь, за счет s-электрона, вообще безразлична к направлению.
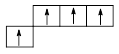
Метод ВС не способен объяснить четыре одинаковые связи атома углерода, наблюдающиеся в огромном числе соединений. Напрашивается выход из создавшейся ситуации – нужно произвести выравнивание различных орбиталей, сделать их одинаковыми. Это и есть существо гибридных представлений.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 927; Нарушение авторских прав?; Мы поможем в написании вашей работы!