
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод Гиллеспи
|
|
|
|
Простым и удобным методом предсказания геометрии молекул является модель отталкивания локализованных электронных пар или метод Гиллеспи, имеющий в своей основе метод ВС. Исходными данными для указанного метода являются число связанных с центральным атомом других атомов, валентные возможности всех связанных атомов, количество электронов на внешнем слое центрального атома. Основные положения метода Гиллеспи сводятся к следующему.
1. Каждая электронная пара, как образующая связь, так и неподеленная, занимает определённое место в пространстве (локализованная электронная пара). Облако двойной и тройной связи рассматривается как единое. Разумеется, электронные пары (электронные облака) отталкиваются.
2. В зависимости от числа локализованных электронных пар (электронных облаков) они располагаются в пространстве следующим образом:
2 – линейная конфигурация,
3 – правильный треугольник,
4 – тетраэдр,
5 – правильная тригональная бипирамида,
6 – октаэдр,
7 – октаэдр с искажением или правильная пентагональная пирамида.
Процедура работы по методу Гиллеспи примерно следующая. Обозначим центральный атом буквой А, любой связанный с ним другой атом – буквой В, неподелённую электронную пару – буквой Е. Пусть общее число партнёров центрального атома по химической связи – n, а число неподелённых электронных пар у него – m. Тогда рассматриваемая молекула в своеобразном свёрнутом виде относительно центрального атома запишется ABnEm. Разумеется, в качестве центрального атома выбирается самый многовалентный атом. Сложные, громоздкие молекулы в рамках метода Гиллеспи рассматриваются по частям. В результате суммирования n и m по предложенному выше методу определяется исходная модель геометрии молекулы или иона, а затем после своеобразного отбрасывания неподелённых электронных пар – собственно геометрия частицы.
Возможные дополнения к методу Гиллеспи:
а) облако двойной связи занимает в пространстве бóльшее место, чем облако однократной связи;
б) облако тройной связи занимает в пространстве бóльшее место, чем облако двойной связи и тем более, чем облако однократной связи;
в) в случае полярной ковалентной связи электронное облако сконцентрировано в большей степени возле более электроотрицательного атома;
г) облако неподелённой электронной пары занимает в пространстве бóльшее место, чем облако однократной связи.
Эти дополнения позволяют производить уточнения к геометрии молекул, отклонения от валентных углов, предсказываемых основной процедурой.
Продемонстрируем возможности метода Гиллеспи на примере нескольких молекул. Начнём с разобранных выше молекул воды и аммиака.
Н2О; АВ2Е2; 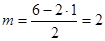 ; исходная модель – тетраэдр; молекула – уголковая, угол Н–О–Н 109о28'.
; исходная модель – тетраэдр; молекула – уголковая, угол Н–О–Н 109о28'.
NH3; АВ3Е1;  ; исходная модель – тетраэдр; молекула – тригональная пирамида, угол Н–N–Н 109о28'. Обратим внимание, что тетраэдр, являющийся правильной тригональной пирамидой, более старшая фигура (центральный атом и четыре партнёра по химической связи), чем собственно тригональная пирамида (центральный атом и три партнёра по химической связи).
; исходная модель – тетраэдр; молекула – тригональная пирамида, угол Н–N–Н 109о28'. Обратим внимание, что тетраэдр, являющийся правильной тригональной пирамидой, более старшая фигура (центральный атом и четыре партнёра по химической связи), чем собственно тригональная пирамида (центральный атом и три партнёра по химической связи).
Еще несколько примеров.
SnCl2; АВ2Е1; 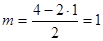 ; исходная модель – правильный треугольник; молекула – уголковая, угол Cl–Sn–Cl равен 120о или меньше в силу того, что свободная электронная пара занимает бóльшее место в пространстве, чем связывающая пара.
; исходная модель – правильный треугольник; молекула – уголковая, угол Cl–Sn–Cl равен 120о или меньше в силу того, что свободная электронная пара занимает бóльшее место в пространстве, чем связывающая пара.
СО2; АВ2Е0; 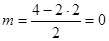 ; линейная молекула.
; линейная молекула.
Анионы кислот проще всего рассматривать также, как и молекулы самих кислот: H2SO4 и SO42– AB4E0; H3PO4 и PO43– AB4E0; H2СO3 и СO32– AB3E0 и т.д.
В ряде случаев возможны несколько моделей строения частиц в рамках метода Гиллеспи, выбирается энергетически более выгодная. Например, XeF2; AB2E3; исходная модель – тригональная пирамида, возможны варианты:
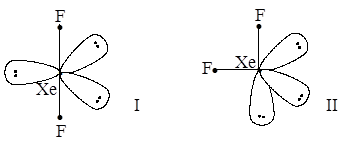
Первый вариант энергетически более выгоден: электронные пары максимально разведены, максимально удалены и атомы фтора, имеющие одинаковые эффективные заряды. Вывод: молекула XeF2 – прямолинейна.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 12563; Нарушение авторских прав?; Мы поможем в написании вашей работы!