
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия термодинамической системы
|
|
|
|
Законы и уравнения термодинамики идеального газа
Законы и уравнения термодинамики идеального газа установлены в результате обобщения очень большого количества экспериментальных данных. Это такие законы и уравнения как закон Бойля - Мариотта:
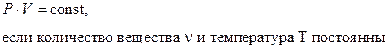 (4.3.5)
(4.3.5)
(изотермический процесс);[1]
закон Гей-Люссака:
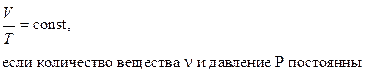 (4.3.6)
(4.3.6)
(изобарический процесс);
закон Шарля:
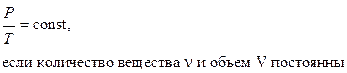 (4.3.7)
(4.3.7)
(изохорический процесс).
На рисунках 4.3.1... 4.3.3 представлены графики изотермических,
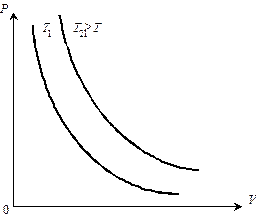 |
изобарических и изохорических процессов, соответственно.
Рис. 4.3.1.Изотермы идеального газа
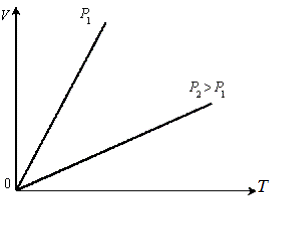 |
Рис. 4.3.2.Изобары идеального газа
Рис. 4.3.3.Изохоры идеального газа
Кроме термодинамических параметров P,V и T термодинамическая система характеризуется некоторой функцией состояния U, которая называется внутренней энергией.
Если обозначить полную энергию макросистемы через Е, кинетическую и потенциальную энергию системы в целом через ЕК и ЕР, то полная энергия Е системы будет равна:
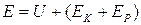 . (4.3.8)
. (4.3.8)
Сумма энергий ЕК и ЕР называется внешней энергией системы, а составляющая U полной энергии системы — энергией покоя, или внутренней энергией. В термодинамике движение системы как целого обычно не рассматривается, поэтому энергией системы оказывается ее внутренняя энергия U. Внутренняя энергия — внутренний параметр термодинамической системы. Она может изменяться только при взаимодействии системы с внешними телами. В изолированной системе, а также вне силовых полей, внутренняя энергия, как следует из закона сохранения энергии, не меняется. Это условие можно написать в виде:
U = const.
Это означает, что внутренняя энергия однозначно определяется состоянием системы: каждому состоянию системы присуще только одно значение энергии. Изменение энергии при переходе системы из одного состояния в другое описывается соотношением
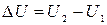
и не зависит от того, какие состояния принимала система в промежутке между начальным и конечным состояниями.
Считается, что изменение энергии не зависит от пути, по которому система переходит из одного состояния в другое, а определяется только параметрами начального и конечного состояний. Величины, обладающие таким свойством, называются функциями состояния. Внутренняя энергия — функция состояния системы.
Внутренняя энергия системы — параметр, подчиняющийся закону аддитивности: энергия системы равна сумме энергий частей, составляющих систему.
Как можно изменить внутреннюю энергию системы?
С точки зрения термодинамики существуют два принципиально различных взаимодействия системы с внешними телами и, следовательно, два способа изменения состояния.
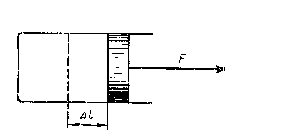 |
Первый способ — совершение системой работы. Например, поршень перемещается в цилиндре (рис. 4.3.4) на расстояние
 под действием силы F. При этом совершается работа (в обычном механическом смысле), равная
под действием силы F. При этом совершается работа (в обычном механическом смысле), равная
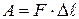 (4.3.9)
(4.3.9)
Рис. 4.3.4.Поршень совершает работу
Второй способ изменения состояния системы — осуществление теплообмена между системой и внешними телами. Первый способ связан с изменением внешних параметров системы, второй способ не связан с изменением внешних параметров системы. При том и другом взаимодействии происходит обмен энергией между системой и внешними телами.
Количество энергии, переданное системой (системе) в процессе расширения или сжатия газа, называют работой А. Работу А принято считать положительной, если при этом энергия передается от системы внешним телам (работу совершает система). В противном случае величина работы А считается отрицательной (работа совершается над системой).
Количество энергии, переданное системой (системе) в процессе теплообмена, называют количеством теплоты, или теплотой Q. Теплота Q считается положительной, если она передается от внешних тел к системе, и отрицательной, если она передается от системы внешним телам.
Передачей энергии путем совершения работы и путем теплообмена обусловлены все процессы, происходящие с термодинамической системой. Такая передача энергии не должна сопровождаться переходом вещества от внешних тел к системе или от системы к внешним телам.
Таким образом, изменение внутренней энергии можно описать уравнением:
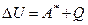
где 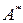 - работа, совершаемая над системой;
- работа, совершаемая над системой; 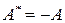 . Здесь А – работа, совершаемая самой системой над внешними телами.
. Здесь А – работа, совершаемая самой системой над внешними телами.
Работу А можно вычислить по изменениям параметров самой системы. (см.ниже).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 627; Нарушение авторских прав?; Мы поможем в написании вашей работы!