КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Технология серной кислоты
|
|
|
|
Раздел 2. Технология органических и неорганических веществ
Контрольные вопросы к теме V
«Топливо и энергия в химической промышленности»
1. Какие виды энергии и с какой целью используются в химической промышленности?
2. Что такое энергоемкость химического производства и на какие классы она делится? Приведите примеры.
3. Перечислите основные источники энергии и классифицируйте их.
4. Чем характеризуемся энергетическая ценность химического топлива?
5. На чем основано использование водорода в энергетике?
6. В чем особенности и преимущества использования новых видов энергии в химическом производстве?
7. Перечислите основные пути рационального использования энергии в химической промышленности.
8. Что такое вторичные энергетические ресурсы (ВЭР)? Приведите пример.
9. Для каких целей используются в химической промышленности плазмохимические процессы?
| Народнохозяйственное значение производства серной кислоты. Баланс сырья, сравнительная оценка серосодержащего сырья. Получение сернистого газа, очистка от примесей. Контактный способ производства серной кислоты. Физико-химические основы процесса. Катализаторы. Контактные аппараты. Современные технологические схемы производства. Использование тепла в производстве серной кислоты. |
Серная кислота — один из важнейших продуктов химической промышленности. Безводная серная кислота, или моногидрат — это маслянистая жидкость, более тяжелая, чем вода. Плотность серной кислоты (вес 1 мл ее при 0° С) равна 1,84 г/см3; в этих же условиях плотность воды составляет 1 г/см3.
Серная кислота отличается высокой химической активностью — очень легко вступаете химические реакции. Она энергично реагирует с металлами, вытесняет другие кислоты из их солей, очень жадно соединяется с водой. Дерево, другие растения, а также живые ткани быстро разрушаются серной кислотой и при этом чернеют. Работающие с серной кислотой должны соблюдать особую осторожность.
Высокая химическая активность серной кислоты дает возможность получать из нее или с ее помощью другие вещества.
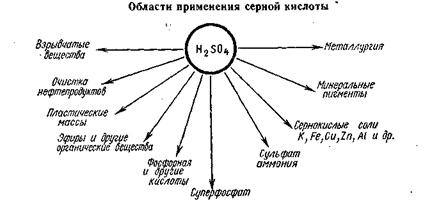
Серную кислоту используют буквально во всех отраслях химической промышленности. Она служит одним из главных химических продуктов, определяющих развитие химической промышленности — недаром называют ее «хлебом химии». В химической промышленности серную кислоту используют для производства удобрений — суперфосфата, сульфата аммония, аммофоса и др. В СССР около половины вырабатываемой кислоты расходуется на производство удобрений.
Серная кислота необходима для получения красителей, пластических масс, химических волокон, фармацевтических препаратов. Значительные количества серной кислоты расходуются при получении нефтепродуктов — жидких топлив, смазочных масел.
Потребление серной кислоты не исчерпывается химической промышленностью. Выделение металлов из руд в металлургии, травление металлов на машиностроительных заводах, обработка волокна и тканей разбавленными растворами серной кислоты перед крашением на текстильных фабриках, получение крахмала, патоки и спирта на предприятиях пищевой промышленности — вот неполный перечень областей использования серной кислоты в различных отраслях промышленности. Серная кислота имеет большое значение и для оборонной промышленности — ее применяют при производстве взрывчатых веществ и пор охов.
Серная кислота, используемая в промышленности, называется технической. Она представляет собой растворы серной кислоты в воде. Содержание (концентрация) серной кислоты в этих растворах может быть различной: так, башенная кислота содержит 75—78% H2SO4 и 22—25% Н2О. Вырабатываемая в больших количествах контактная кислота — более концентрированная и чистая, чем башенная — в ней 92,5% Н2SО4 и 7,5 %Н2О. Значительное использование получили также растворы серного ангидрида (SO3) в серной кислоте, называемые олеумом. В олеуме содержится 18—20% SO3, остальное — H2SO4. В табл. 2 приведена характеристика сортов серной кислоты, вырабатываемой в промышленности.
Сорта серной кислоты
| Кислота | Содержание, вес. % | |
| Н2SO4 | SO3 | |
| Контактная: | ||
| - техническая | 92,5 | - |
| - техническая улучшенная | 92,5-94 | - |
| Олеум | 81,5 | 18,5 |
| «Башенная» | 75,0 | - |
Процесс получения серной кислоты протекает по двум реакциям:
2SO2 + О2 = 2SO3 (VI, 1)
SO3 + H20 = H2S04 (VI, 2)
Реакция (VI, 1) описывает окисление сернистого ангидрида, в результате чего получается серный ангидрид. Вторая реакция (VI, 2) показывает взаимодействие серного ангидрида с водой с получением серной кислоты.
Из уравнений (VI, 1) и (VI, 2) следует, что для получения серной кислоты необходим кислород. Для этой цели используется кислород, содержащийся в воздухе. Следовательно, первым сырьевым материалом для производства серной кислоты является воздух, вторым — вода, третьим — сернистый ангидрид. Откуда же берут сернистый ангидрид? Сырьем для получения сернистого ангидрида, а следовательно, и серной кислоты служит сера или материалы, в состав которых входит сера.
С е р а — твердое желтое вещество, имеющее температуру плавления 113° С и кипящее при 444,6° С. Сера встречается в природе в так называемых серных рудах, в которых она смешана с другими веществами. При нагревании серной руды сера, расплавляясь, вытекает из нее. На этом принципе основан один из методов извлечения ее из серных руд.
Сера может быть также получена из отходящих газов заводов цветной металлургии по реакциям:
2H2S + О2 = S2+2H2O (VI,3)
2CS2 + 2SO2 = 3S2 + 2CO2 (VI,4)
4CO + 2SO2 = 3S2 + 4CO2 (VI,5)
Богатые залежи серы расположены на Украине, в Средней Азии. Развитие процессов получения серы из отходящих газов увеличивает значение серы для отечественной сернокислотной промышленности.
Серный колчедан — желтовато-серый с блестящими вкраплениями камень — является в СССР основным сырьем для производства серной кислоты. В состав колчедана входит минерал пирит (FeS2). Содержание серы в колчедане колеблется от 35 до 50%, а железа— от 30 до 43%. Остальное составляют примеси — соединения меди, цинка, свинца, мышьяка, селена и др.
Советский Союз располагает мощными месторождениями серного колчедана на Урале и на Кавказе. Добытый на рудниках этих месторождений колчедан в виде кусков различной величины доставляют на химические заводы. Такой колчедан называют рядовым.
Помимо этого, серный колчедан может быть получен из медных руд, идущих на производство меди и имеющих в своем составе FeS2. При переработке медной руды на специальных предприятиях — обогатительных фабриках получают продукт, в котором содержится много меди (медный концентрат) и отход (флотационные хвосты), богатый серным колчеданом. Медный концентрат поступает на медеплавильные заводы, а отход производства — флотационные хвосты, являющиеся важнейшим сырьем для производства серной кислоты, — на химические заводы. Таким образом, мы видим, что медные руды используются комплексно.
Газы металлургических печей, в которых перерабатывают руды меди, цинка и других цветных металлов, содержат сернистый ангидрид. Эти газы, выходя из печей, загрязняют атмосферный воздух, губят растительность и вредно отражаются на здоровье людей. Использование отходящих газов цветной металлургии имеет большое народнохозяйственное значение, так как позволяет одновременно решить две задачи — получение серной кислоты без затрат колчедана или серы и обезвреживание атмосферы.
Сероводород извлекают из газов, получаемых при химической переработке углей и нефти. Его окисляют кислородом воздуха до сернистого ангидрида:
2H2S + ЗО2 = 2S02 + 2Н2О (VI,6)
или до элементарной серы:
2H2S + О2 = 2S + 2Н2О (VI,7)
Полученные при этом SO2 или серу используют для производства серной кислоты.
Производство сернистого газа.
Для получения сернистого газа серу сжигают в воздухе. При этом происходит реакция
S + 02 = SO2 (VI, 8)
Сжигание серы проводят в простых по устройству печах. При этом получают сернистый газ, не загрязненный вредными примесями.
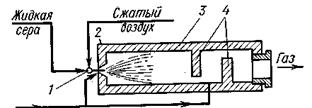
| |
| Схема печи для сжигания серы: 1- форсунка, 2 - стальной горизонтальный цилиндр, 3 -футеровка из огнеупорного кирпича, 4 — перегородки | Измельчение колчедана: 1- неподвижная щека, 2- колчедан, 3- стальной вал, 4- моховое колесо, 5-подвижная щека, 6-валки |
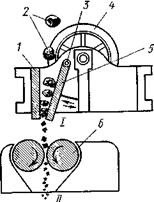
Печь для сжигания серы представляет собой стальной цилиндр 2, футерованный огнеупорным кирпичом 3. Расплавленная сера воздухом через форсунку 1, подается в печь. Для лучшего смешения продуктов внутри печи имеются перегородки 4. При высокой температуре в печи сера загорается – образуется факел горящей серы.
Горение серы происходит во всем объеме печи и заканчивается в камерах, образованных перегородками 4, куда подается дополнительное количество воздуха. Из этих камер выводится горячий печной газ, содержащий сернистый ангидрид.
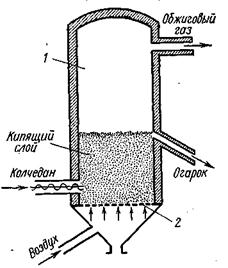
Переработка серного колчедана
Этот процесс описывается реакцией
4FeS2 + 11О2 = 2Fe2O3 + 8SO2 + 815,2 ккал. (VI, 9)
При взаимодействии FeS2 с кислородом воздуха, как видно из реакции (VI, 9) выделяется значительное количество тепла, в результате чего температура в печи, в которой проводится процесс, повышается до 700—800° С. Продуктами обжига колчедана являются о б ж и г о в ы й, или п е ч н о й, г а з, который содержит примерно 8—10% SO2, около 10—11% кислорода, а остальное азот, поступивший в печь с воздухом, и колчеданный огарок — красно-коричневый продукт, в основном состоящий из окиси железа.
Обжиг колчедана протекает интенсивно при высоких температурах, так как при этом увеличивается скорость реакции. Обжиг колчедана — это гетерогенный процесс, и поэтому для его интенсификации необходимо иметь возможно большую поверхность соприкосновения между частицами колчедана и воздуха. Это достигается измельчением колчедана и его перемешиванием в воздушном потоке в процессе обжига.
Измельчение колчедана, если он поступает на завод в виде крупных кусков, сначала производится в щековых дробилках I. Дробилка имеет две плиты, или «щеки», из которых одна (1) неподвижная, а вторая (5) — подвижная. Колчедан подается в пространство между плитами. Подвижная щека, подвешенная на стальном валу 3, периодически приближается к неподвижной и раздавливает колчедан, находящийся между ними. После щековой дробилки куски колчедана еще относительно велики и он поступает для окончательного измельчения в валковую дробилку II, в которой куски материала раздавливаются между двумя вращающимися навстречу друг другу стальными цилиндрами (валками).
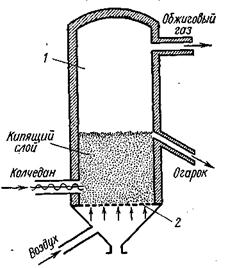
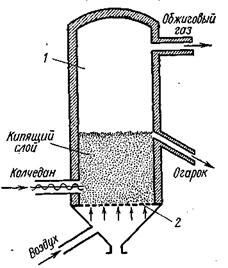
Обжиг колчедана производится в печах различной конструкции при температуре около 800° С. Наибольшее распространение получили механические печи и печи «кипящего» слоя.
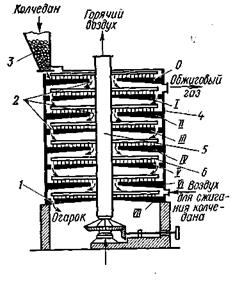
Механическая или полочная печь представляет собой вертикальный цилиндрический аппарат 4 высотой около 12 м, футерованный огнеупорным кирпичом. По высоте печь разделена на восемь полок (сводов). Через центр печи проходит вал 5, на котором над каждым сводом укреплено по два гребка 6 с зубьями. Измельченный колчедан из бункера 3 подается на верхний свод (0) печи, и гребками с зубьями перемещается от периферии к центру свода, где он через питатель у вала ссыпается на следующий свод. На верхнем своде происходит подсушка колчедана.
Следующие полки являются «рабочими» — на них протекает процесс обжига колчедана. На первом рабочем своде (I) гребки с зубьями перемещают колчедан от центра к периферии, откуда через отверстия 2 колчедан поступает на второй рабочий свод (II). На своде колчедан передвигается к центру печи, где ссыпается через кольцевое отверстие 2 вокруг вала на третий свод (III) и т.д. С последнего свода печи выводится огарок.
Наиболее высокая температура — 850° С обычно на третьем своде. Необходимый для обжига воздух подается через специальные отверстия — «воздушники», расположенные в кожухе печи у последнего свода. Образующиеся газы поднимаются навстречу обжигаемому колчедану через те же отверстия в сводах, по которым проходит твердый материал, и выводятся из печи сверху.
В такой печи обжигают около 35 т колчедана в сутки (в пересчете на 45%-ный по содержанию серы колчедан), что соответствует 200 кг/м3 объема печи в сутки.
|

|
| 
|
| Схема механической (полочной) печи: О, 1 — VII — своды; 1 — вывод огарка, 2 —отверстия в сводах II, 3 — бункер, 4 —цилиндр, 5 — вал, 6 — гребки | Схема печи «кипящего» слоя: 1 — камера, 2 — решетка |
|
Печь «кипящего» слоя (КС) представляет собой полую вертикальную камеру 1, в нижней части которой находится решетка 2 (наподобие колосниковой). На решетку непрерывно поступает мелкораздробленный колчедан, а под решетку вдувается воздух. Воздух проходит через отверстия решетки с большой скоростью, поднимает и перемешивает находящийся на решетке колчедан. Слой колчедана напоминает по внешнему виду кипящую жидкость (откуда и название — печь «кипящего» слоя). Температура в печи около 800° С. Сверху из печи отводится обжиговый газ, а через переточную трубу — огарок. В печи «кипящего» слоя можно обжигать до 2000 кг/м3 объема печи в сутки, т. е. примерно в 10 раз больше, чем в механических полочных.
Газ, выходящий из обжиговых печей, уносит мелкие частицы огарка. Чтобы не загрязнить получаемую в дальнейшем кислоту и не засорять аппаратуру, обжиговый газ очищают от пыли.
Очистка обжигового газа от пыли.
Наиболее успешно этот процесс осуществляется в электрофильтрах, принцип действия которых 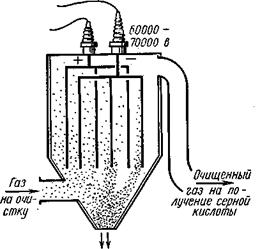 представлен на рис. Электрофильтр питается постоянным током высокого напряжения 60 000 — 70 000 в. В поле постоянного тока такого напряжения пылинки получают отрицательный электрический заряд и движутся к положительно заряженному электроду, разряжаются на нем и падают вниз. Очищенный от пыли обжиговый газ содержит около 9%SO2, 9—10% О2 и около 80% N2.
представлен на рис. Электрофильтр питается постоянным током высокого напряжения 60 000 — 70 000 в. В поле постоянного тока такого напряжения пылинки получают отрицательный электрический заряд и движутся к положительно заряженному электроду, разряжаются на нем и падают вниз. Очищенный от пыли обжиговый газ содержит около 9%SO2, 9—10% О2 и около 80% N2.
Огарок. Образующийся при обжиге колчедана огарок содержит до 50% Fe. Из 1 т серной кислоты получается около 0,6 т огарка. Таким образом, количество огарка составляет миллионы тонн в год и он может быть использован для производства чугуна. Однако удаляемый из обжиговых печей огарок непригоден непосредственно для доменного процесса — он очень мелкий и содержание в нем цветных металлов превышает нормы, допустимые для доменного процесса. Поэтому перед тем как передать огарок на доменную плавку, его подвергают предварительной обработке. Огарок может быть также использован в производстве цемента, для получения минеральных красок и др.
Переработка сернистого газа в серную кислоту
Производство серной кислоты из сернистого газа заключается во взаимодействии сернистого газа SO2 и кислорода О2, содержащихся в обжиговом газе (реакция VI, 1). В результате этого процесса образуется серный ангидрид SO3, который затем поглощается водой с получением серной кислоты (реакция VI,2).
Первая реакция в обычных условиях протекает крайне медленно, и для ее ускорения необходим катализатор. В зависимости от способа окисления SO2 в SO3 серную кислоту получают двумя способами: нитрозным и контактным.
Контактный способ
Этот способ производства серной кислоты описывается двумя показанными ранее реакциями:
2SO2+O2=2SO3 (VI,1)
SO3+H2O=H2SO4 (VI,2)
Окисление сернистого ангидрида в серный в обычных условиях не происходит, так как эта реакция протекает с очень малой скоростью. Для ее ускорения используют ванадиевый катализатор, содержащий пятиокись ванадия V2O5. Иногда катализаторы называют «к о н т а к т а м и». Отсюда и метод называют контактным методом производства серной кислоты.
Катализатор работает длительное время без замены его свежим при условии очистки обжигового газа не только от пыли, но и от вредных примесей, таких, как As2O3, SeO2, пары воды, которые попадают в него из колчедана при обжиге.
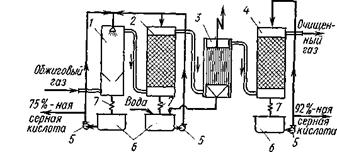
Очистка обжигового газа:
1, 2— промывные башни, 3 — «мокрый» электрофильтр, 4 — сушильная башня, 5 —насосы, 6 — сборники, 7 — холодильники
Очистка обжигового газа начинается с удаления пыли в электрофильтре. Затем газ поступает в так называемые промывные башни 1, 2, которые орошаются разбавленной серной кислотой. Кислота охлаждает газ и растворяет соединения мышьяка и селена, частично освобождая от них газ. При промывке газа разбавленной серной кислотой образуется туманообразная серная кислота, содержащая As2O3. Если частицы тумана попадут на катализатор, то они «отравят» его и катализатор выйдет из строя. Поэтому частицы тумана удаляют в так называемом «мокром» электрофильтре 3, принцип действия которого такой же, как и у электрофильтра для осаждения пыли — частицы тумана в поле высокого напряжения ионизируются и разряжаются на электроде. Пройдя мокрый электрофильтр, газ освобождается от водяных паров в насадочной башне 4, орошаемой концентрированной серной кислотой. Эта башня называется сушильной. После нее газ передается в контактный аппарат для окисления SO2 в SO3.,
Окисление SO2 в SO3 представляет собой обратимую реакцию, протекающую с выделением тепла:
2SO2 + О2 = 2SO3 + 45,2 ккал (VI, 17)
Как известно, в этом случае для того чтобы сдвинуть равновесие реакции слева направо, целесообразно проводить процесс при низких температурах. Однако при низких температурах реакция будет протекать с очень малой скоростью и поэтому степень превращения SO2 в SO3 окажется очень небольшой. Исходя из этого находят такую температуру, при которой скорость реакции будет высокой и достаточно высокой окажется степень превращения сернистого ангидрида в серный. Такая температура называется оптимальной; для реакции (VI, 17) она соответствует примерно 440°—500° С. Нагревают газ до этой температуры в трубчатом теплообменнике.
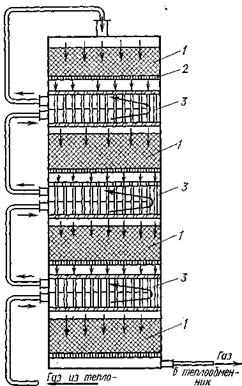
| Контактный аппарат: 1-катализатор, 2-полка, 3-теплообменник |
Контактный аппарат имеет полки 2, на которые насыпан катализатор 1. Между полками с катализатором находятся трубчатые теплообменники 3. Газ поступает в аппарат снизу и последовательно проходит через межтрубное пространство теплообменников, где нагревается до 450° С в результате теплообмена с газами, прошедшими через катализатор. При температуре 450° С газ поступает в первый слой контактной массы. Здесь протекает реакция образования SO3 (VI, 17), при которой происходит выделение тепла, и температура газа повышается.
Газ, выходящий из первого слоя контактной массы (I), попадает в трубки верхнего теплообменника 3, где он охлаждается идущим на контактирование газом, находящимся в межтрубном пространстве. После этого газ проходит во второй слой контактной массы (I), в котором происходит реакция (VI, 17), вновь нагревается, затем вновь отдает тепло во втором теплообменнике и т. д. Таким образом, с помощью теплообменников регулируется температура, при которой протекает реакция (VI, 17), Производительность контактных аппаратов — около 300 т H2SO4 в сутки. В настоящее время строятся контактные аппараты высокой мощности, имеющие производительность 1000—1200 т H2SO4 в сутки.
Для получения серной кислоты необходимо поглотить серный ангидрид водой (реакция VI, 2) или серной кислотой. Для этого горячий газ, выходящий из контактного аппарата с температурой около 450° С, охлаждается в трубчатом холодильнике водой и поступает в башню с насадкой, орошаемую водой или серной кислотой. Из башни вытекает либо концентрированная (контактная) кислота, либо олеум, получающийся в результате растворения серного ангидрида в серной кислоте.
Схематически контактный метод получения серной кислоты изображен в табл. 1.
Можно сравнить способы получения серной кислоты, рассмотрев показатели нитрозного и контактного способов получения серной кислоты, которые приведены в табл. 2.
Таблица 2
Сравнение контактного и нитрозного способов
производства серной кислоты
| Показатель | Нитрозный способ | Контактный способ |
| Концентрация кислоты, вес. % Примеси Расход энергии, кВт·ч/т Стоимость 1 т, руб. | Соединения мышьяка, окислы азота 30—40 21—00 | 92,5—94 Олеум,18,5—20SO3 - 60-100 29-60 |
Из табл. 2 следует, что при контактном процессе получается кислота более концентрированная и чистая, но более дорогая, чем при нитрозном способе. Такая контактная кислота используется при получении химических волокон, пластических масс, красителей, этилового спирта и др. Башенная кислота, получаемая при нитрозном способе производства, применяется главным образом там, где не требуется кислота высокой концентрации, например при производстве удобрений.
Контактный способ получения серной кислоты

|

|
| Процесс | Что происходит | В каких аппаратах | |||||||||||||||||||||||||||||||||||

| Удаление пыли из газа Охлаждение газа и удаление вредных примесей Нагревание газа 2SO2+O2=2SO3 Охлаждение газа SO3 +H2O=H2SO4 охлаждение кислоты |
 
|
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 2800; Нарушение авторских прав?; Мы поможем в написании вашей работы!