
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фосфорные удобрения
|
|
|
|
Классификация удобрений
В почву азота, фосфора, калия
Примерный прирост урожая при внесении
| Сельскохозяйственные культуры | В тоннах на тонну внесенного | ||
| N | P2O5 | K2O | |
| Сахарная свекла | |||
| Картофель | |||
| Хлопок-сырец | |||
| Лен-волокно | 2,5 | 1,5 | |
| Озимая пшеница (зерно) |
Количество химических элементов, вносимых с удобрениями на 1 га посевной площади, колеблется примерно в следующих пределах: азота 30—120 кг, фосфора (в пересчете на фосфорный ангидрид Р2О5) 40—120 кг, калия (в пересчете на окись калия К2О) 40—200 кг. Результаты, получаемые при применении удобрений, показаны в табл. 1.
Удобрения классифицируются по происхождению, агрохимическому значению, составу и количеству входящих в них питательных элементов.
По происхождению удобрения подразделяются на естественные и искусственные.
Естественные удобрения — это природные вещества, не подвергнутые переработке: навоз, зола растений, так называемые агрономические руды (фосфориты и апатиты). Естественные удобрения в больших количествах используются в сельском хозяйстве, однако питательные элементы иногда находятся в них не в том количестве и не в тех сочетаниях, как это необходимо для увеличения урожайности.
Процесс усвоения питательных элементов растениями заключается в растворении удобрений в почвенных водах и поглощении полученных растворов корневой системой растений. Таким образом, необходимым условием для усвоения питательных элементов растениями является растворимость удобрений. В агрономических рудах — апатите и фосфорите содержится значительное количество фосфора, но эти руды нерастворимы в воде и поэтому находящийся в них фосфор чрезвычайно медленно усваивается растениями, т. е. фосфор находился в «неусвояемой» или «трудноусвояемой» форме. Недостатки, присущие естественным удобрениям, а также необходимость увеличения количества удобрений выдвигают необходимость всемерного развития процессов синтеза искусственных удобрений.
Искусственные удобрения, получаемые переработкой природных материалов, могут содержать высокий процент питательных элементов в различном их соотношении.
По происхождению удобрения можно также подразделять на минеральные, органические, органо-минеральные и бактериальные. К минеральным удобрениям, в значительных количествах вырабатываемых на химических предприятиях, относятся главным образом неорганические соли, из органических соединений — карбамид (мочевина). Органические удобрения содержат питательные элементы, входящие в состав органических соединений. Органо-минеральные удобрения — смесь органических и минеральных удобрений. Бактериальные удобрения содержат культуры бактерий, которые способствуют накоплению в почве усвояемых форм питательных элементов.
По агрохимическому значению удобрения делятся на прямые и косвенные. Прямые удобрения содержат питательные элементы, например азот, фосфор, калий, которые усваиваются растениями, т. е. прямые удобрения являются пищей для растений. Косвенные удобрения вносят в почву для улучшения ее физических, химических и биологических свойств. В качестве косвенных удобрений используют известняк, доломит, гипс и др.
По составу, т. е. по видам питательных элементов, прямые удобрения подразделяются на азотные, фосфорные, калийные, магниевые и др. В отдельную группу входят микроудобрения.
По количеству питательных элементов удобрения подразделяются на простые, или односторонние, и комплексные, или многосторонние.
Простые, или односторонние, удобрения содержат только один питательный элемент — азот, фосфор или калий. Например, суперфосфат содержит монокальцийфосфат Са(Н2РО4)2, т. е. в нем имеется только один питательный элемент — фосфор, и он представляет собой простое фосфорное удобрение. Аммиачная селитра NH4NO3, в которой из питательных элементов содержится только азот, относится к простым азотным удобрениям. КС1 содержит питательный элемент калий и является простым калийным удобрением.
Комплексные, или многосторонние, удобрения содержат несколько питательных элементов в различных сочетаниях. Например, удобрение аммофос [NH4H2PO4 + (NH4)2HPO4] содержит два питательных элемента — азот и фосфор, калийная селитра KNO3 — калий и азот, а нитрофоска, представляющая собой смесь солей [NH4N03 + NH4H2PO4 + CaHPO4 ·2H2O + КСl + CaSO4 ·2H2O], имеет в своем составе азот, фосфор и калий.
Различают сложные и смешанные многосторонние удобрения. Смешанные удобрения получают механическим смешением односторонних удобрений; к таким удобрениям относится, например, нитрофоска. Сложные удобрения образуются в результате химических реакций. Так, калийную селитру получают реакцией обменного разложения NaNO3 и КС1.
По количеству питательных элементов в удобрениях их также подразделяют на концентрированные и неконцентрированные, или ординарные. Обычно количество азота в удобрениях выражается в процентах азота (N), количество фосфора — в пересчете на процент фосфорного ангидрида (Р2О5), калия — в пересчете на процент окиси калия (К2О). Концентрация питательных элементов во многом определяет качество удобрений. Чем выше концентрация питательных веществ и меньше балласта, тем ценнее удобрение. Применение концентрированных удобрений позволяет сократить расходы на перевозку удобрений от заводов до колхозов и совхозов, на тару и хранение удобрений, а также на внесение удобрений в почву. В связи с этим перед промышленностью ставится задача увеличения выпуска концентрированных удобрений.
Помимо высокой концентрации питательных веществ, качество удобрений определяется их физическими свойствами. Удобрения должны быть сухими, рассыпчатыми, удобными для рассева механическими сеялками. Они не должны слеживаться в глыбы или крупные комки. Частицы удобрений должны быть не слишком крупными, чтобы растениям было легче извлекать из них питательные вещества, но и не слишком мелкими, иначе они будут разноситься ветром, распыляться при транспортировке. В связи с этим выпускают гранулированные удобрения — в виде шариков диаметром 2—4 мм.
Показателем качества удобрений является способность их впитывать влагу — гигроскопичность. Гигроскопичность удобрений определяет условия их транспортировки, хранения, характер тары.
Сырье. Фосфорсодержащие соединения в больших количествах дает природа в виде так называемых фосфатных руд, или природных фосфатов, — апатитов и фосфоритов. Крупнейшее месторождение апатитов, расположенное в Хибинах на Кольском полуострове, не имеет себе равных в мире. Честь открытия этого месторождения принадлежит академику А. Е. Ферсману. Мощные месторождения фосфоритов находятся в Казахстане (месторождение Кара-Тау), на Урале, Украине, в Подмосковье.
В состав фосфоритов и апатитов входит трикальцийфосфат Са3(РО4)2 и фторапатит Са5F(РО4)3; эти соединения служат источником фосфора, необходимого для растений.
Примеси, находящиеся в фосфорных рудах, значительно снижают в них концентрацию Р2О5. Некоторые примеси оказывают вредное влияние на переработку руд и качество получаемых из них удобрений. Особенно нежелательны примеси окислов железа и алюминия (Fe2O3, А12О3) и солей угольной кислоты — карбонатов. Чтобы повысить концентрацию фосфатов кальция в рудах и снизить в них Количество вредных примесей, природные фосфаты подвергают Обогащению.
При измельчении фосфоритов получают фосфоритную м у к у, которую используют в качестве фосфорного удобрения. Однако соединения Са3(РО4)2 и Ca5F(PO4)3 малорастворимы в почвенных водах, и поэтому фосфор, содержащийся в фосфоритной муке, очень мало и медленно усваивается растениями. Таким образом, фосфоритная мука является трудноусваиваемым удобрением и при тонком помоле оказывается эффективной только на кислых подзолистых почвах.
К растворимым фосфорсодержащим соединениям относятся моно-кальцийфосфат Са(Н2РО4)2 и дикальцийфосфат СаНРО4. Монокаль-цийфосфат хорошо растворим в воде и потому хорошо усваивается растениями; содержащие его удобрения называют водорастворимыми. Дикальцийфосфат в воде нерастворим, но растворим в почвенных кислотах и потому усваивается растениями на кислых почвах. Критерием растворимости удобрений, содержащих СаНРО4, служит растворимость их в аммиачном растворе лимоннокислого аммония или в 2%-ном растворе лимонной кислоты. Такого типа удобрения называют цитратнорастворимыми или лимоннорастворимыми. Удобрения водорастворимые, цитратнорастворимые и лимоннорастворимые представляют собой у с в о я е м ы е фосфорные удобрения.
Процесс получения искусственных фосфорных удобрений заключается в переводе трудноусвояемого растениями фосфора, содержащегося в фосфатных рудах, в растворимую, усвояемую форму. Одновременно с этим стремятся к получению фосфорных удобрений с возможно большей концентрацией фосфора.
Современные методы переработки фосфатных руд в искусственные удобрения можно разделить на следующие группы:
1. Разложение природных фосфатов кислотами (серной, азотной, фосфорной, реже соляной). При этом получаются главным образом водорастворимые удобрения — суперфосфат, двойной суперфосфат.
2. Гидротермическая переработка природных фосфатов — обработка водяным паром с получением цитратнорастворимых или лимоннорастворимых, так называемых обесфторенных фосфатов.
3. Разложение природных фосфатов путем спекания или сплавления их при высокой температуре с солями натрия, калия, магния и других щелочноземельных металлов. В результате получаются цитратно- или лимоннорастворимые удобрения — термофосфаты, плавленые фосфаты.
Основные и самые распространенные фосфорные удобрения в настоящее время — суперфосфат и двойной суперфосфат.
Производство фосфорной кислоты. Фосфорную кислоту, необходимую для получения ряда удобрений, в частности двойного суперфосфата, производят из фосфоритов или апатитов экстракционным и электротермическим способами.
Экстракционный способ получения фосфорной кислоты заключается в разложении природных фосфатов, главным образом серной кислотой, по реакции:
Са3 (Р04)2 + 3H2S04 + 6Н20 = 2Н3РО4 + 3 (CaSO4 · 2Н2О)
Фосфорную кислоту (раствор) отфильтровывают от осадка (гипса). Осадок промывают водой для более полного удаления фосфорной кислоты. Однако и после промывки часть фосфорных соединений остается в гипсе, поэтому он получил название фосфогипса.
Установка для получения экстракционной фосфорной кислоты включает сравнительно простые аппараты. Основными являются экстракторы (чаны с мешалкой) и вакуум-фильтры. Экстракционная фосфорная кислота содержит не более 36% Н3РО4. Для производства двойного суперфосфата и других удобрений экстракционную фосфорную кислоту в отдельных случаях упаривают до концентрации 50—75% в барабанных барботажных концентраторах, принципиально мало отличающихся по своему устройству и действию от концентратов, применяемых при упаривании серной кислоты.
Электротермический способ получения фосфорной кислоты заключается в восстановлении в электрических печах при температуре около 1500° С фосфора, содержащегося в природных фосфатах, углеродом в присутствии кремнезема:
Са3 (РО4)2 + 5С + n SiO2 = Р2 + 3 [СаО · n SiO2] + 5CO
При этом фосфор получается в парообразном состоянии. Этот процесс иногда называют электровозгонкой. При окислении (сжигании) паров фосфора, выходящих из печи, или расплавленного фосфора получается фосфорный ангидрид:
2Р2 + 5О2 = 2Р2О5
Далее фосфорный ангидрид взаимодействует с водой. Сначала образуется метафосфорная кислота:
Р205 + Н20 ↔ 2НРО3
которая при охлаждении и наличии избытка воды гидратируется (присоединяет воду) с получением термической фосфорной кислоты Н3РО4, которая отличается высокой чистотой и концентрацией — до 80—95%. Она пригодна для получения ряда солей фосфорной кислоты и синтеза органических соединений. При дешевой электроэнергии термическую фосфорную кислоту целесообразно применять для производства концентрированных удобрений (двойного суперфосфата, преципитата, аммофоса и др.).
Производство простого суперфосфата. Это светло-серый, порошкообразный продукт, в состав которого входит монокалийфосфат Са(Н2РО4)2.
Сырьем для производства суперфосфата служат природные фосфаты — фосфориты и апатиты и башенная серная кислота. Между ними протекает следующая реакция:
Са3(Р04)2 + 2H2S04 + n Н20 = Са(Н2РО4)2 • Н2О + 2[CaS04 • 2Н20]
По реакции получается твердая смесь монокальцийфосфата с гипсом, которая и называется простым суперфосфатом или просто суперфосфатом. Наряду с этим в суперфосфате находятся примеси соединений железа, алюминия, кремния и других элементов, перешедших в него из сырья.
 Взаимодействие природных фосфатов серной кислотой требует длительного времени. Весь процесс производства суперфосфата разбивается на ряд стадий:
Взаимодействие природных фосфатов серной кислотой требует длительного времени. Весь процесс производства суперфосфата разбивается на ряд стадий:
1) измельчение природных фосфатов;
2) смешение природных фосфатов с серной кислотой;
3) «созревание» суперфосфата;
4) измельчение, или «вырезывание», суперфосфата;
5) «дозревание» суперфосфата на складе — завершение взаимодействия Са3(РО4)2 с серной кислотой.
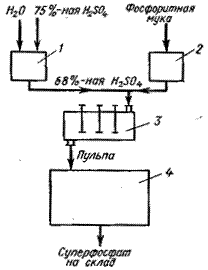
На рис. показана принципиальная схема производства простого суперфосфата. Серная кислота (башенная, концентрацией 75%) непрерывно поступает в дозатор-смеситель 1, где разбавляется водой до концентрации 68%, и затем подается в камерный смеситель 3. Дозировку фосфоритной или апатитовой муки, поступающей из хранилища в производство, осуществляют при помощи автоматических весов 2. Смешивают фосфатную муку с серной кислотой в смесителе 3 непрерывного действия. Полученную в смесителе пульпу направляют в камеру «созревания» непрерывного действия 4, где пульпа «схватывается» (затвердевает), «созревает», затем подвергается вырезке и подается на склад.
Смеситель непрерывного действия представляет собой две или три сообщающиеся камеры 4 с быстровращающимися мешалками 2 и переливной коробкой 3. Фосфорит или апатит и серная кислота подаются в смеситель через входное отверстие (штуцер) 1 в крышке аппарата. Время пребывания образующейся пульпы в смесителе невелико — всего 5—6 мин, и реакция между фосфатом и серной кислотой здесь только начинается. Пульпа перемещается в течение указанного времени по всей длине смесителя, через переливную коробку 3 выходит из него и подается в суперфосфатную камеру.
Суперфосфатная камера представлена на рис. В ней продолжается начавшаяся в смесителе реакция разложения фосфата серной кислотой, происходит «схватывание», затвердевание реакционной массы с образованием пористого куска суперфосфата и его измельчение. Процесс взаимодействия фосфата с серной кислотой очень медленный, и для достаточно полного его протекания реагирующие вещества должны находиться в суперфосфатной камере около 1,5—2 ч.
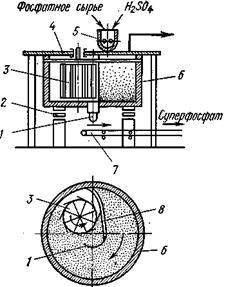
Суперфосфатная камера непрерывного действия представляет собой вертикальный железобетонный цилиндр 6 со стальным кожухом
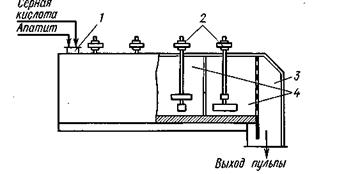
Рис. 53. Схема смесителя непрерывного действия:
1 — штуцер, 2 — мешадка, 3 — переливная коробка, 4 — камеры
и бетонным днищем. Цилиндр 6 медленно (один оборот за 1,5—2 ч) вращается вокруг внутренней неподвижной чугунной трубы 1, установленной на фундаменте и прочно соединенной с неподвижным щитом 8. Внутри камеры помещен вращающийся цилиндр 3 с ножами — так называемая карусель для измельчения (вырезывания) суперфосфата. Карусель вращается в направлении, противоположном вращению цилиндра 6. Суперфосфатная пульпа из смесителя 5 через отверстие в крышке камеры 4 возле неподвижного щита 8 поступает в кольцевое пространство между стенками бетонного цилиндра 6 и трубой 1. Загруженная пульпа перемещается вместе с вращающимся корпусом камеры. Скорость вращения камеры такова, что за время ее полного оборота происходит «созревание» суперфосфата, он затвердевает. «Созревший» к концу оборота камеры суперфосфат срезается ножами карусели 3 и падает через центральную трубу 1 на транспортер, который передает его на склад. Камера диаметром 7 м производит 50 т суперфосфата в час.
Склад в производстве суперфосфата — не только хранилище, но и технологический цех. Дело в том, что реакция между фосфатом и серной кислотой в суперфосфатной камере не завершается. Для ее окончания необходимо время от 6 до 20 суток. Этот процесс «дозревания» суперфосфата заканчивается при хранении его на складе. Содержание Р2О5 в суперфосфате, полученном из апатитового концентрата, составляет около 20 %.
| Схема суперфосфатной камеры непрерывного действия: 1-чугунная труба, 2- роликовая опора, 3- цилиндр с ножами (карусель),4-крышка камеры,5-смеситель, 6-железобетонный цилиндр,7-транспортер,8-неподвижный щит |
 При производстве суперфосфата в нем остается некоторое количество непрореагировавшей кислоты, которая ухудшает качество суперфосфата. Чтобы избавиться от избытка кислоты, ее нейтрализуют добавкой к суперфосфату костяной муки или извести. Иногда нейтрализацию производят аммиаком, и тогда получают аммонизированный суперфосфат, содержащий, кроме фосфора, азот. Обычный измельченный суперфосфат способен комковаться и слеживаться, что затрудняет его рассеивание на полях с помощью сеялок. Помимо этого, частицы порошкообразного суперфосфата быстро растворяются в воде при внесении его в почву и уходят в глубинные слои почвы. Таким образом, корневая система растений не успевает извлечь из удобрения большую часть водорастворимого монокальцийфосфата. Эти недостатки свойств суперфосфата устраняются при его гранулировании. Для этого суперфосфат смачивают водой и пропускают через наклонный обогреваемый вращающийся барабан. При вращении барабана суперфосфат скатывается в шарики — гранулы и получается гранулированный суперфосфат.
При производстве суперфосфата в нем остается некоторое количество непрореагировавшей кислоты, которая ухудшает качество суперфосфата. Чтобы избавиться от избытка кислоты, ее нейтрализуют добавкой к суперфосфату костяной муки или извести. Иногда нейтрализацию производят аммиаком, и тогда получают аммонизированный суперфосфат, содержащий, кроме фосфора, азот. Обычный измельченный суперфосфат способен комковаться и слеживаться, что затрудняет его рассеивание на полях с помощью сеялок. Помимо этого, частицы порошкообразного суперфосфата быстро растворяются в воде при внесении его в почву и уходят в глубинные слои почвы. Таким образом, корневая система растений не успевает извлечь из удобрения большую часть водорастворимого монокальцийфосфата. Эти недостатки свойств суперфосфата устраняются при его гранулировании. Для этого суперфосфат смачивают водой и пропускают через наклонный обогреваемый вращающийся барабан. При вращении барабана суперфосфат скатывается в шарики — гранулы и получается гранулированный суперфосфат.
Как указывалось, в природных фосфатах содержатся примеси Fe2O3 и А12О3. Эти соединения при разложении фосфатов серной кислотой образуют сульфаты железа и алюминия, которые вступают во взаимодействие с Са(Н2РО4)2 и переводят фосфор в соединения, не растворяющиеся в воде. Этот процесс, называемый ретроградацией суперфосфата, приводит к снижению концентрации усвояемого фосфора в продукте. Поэтому стремятся использовать для производства суперфосфата сырье с малым содержанием Fe2O3 и А12О3.
Простой суперфосфат представляет собой неконцентрированное водорастворимое удобрение. Низкая концентрация в нем Р2О5 обусловлена тем, что при разложении природных фосфатов серной кислотой наряду с монокальцийфосфатом образуется гипс (CaSO4 • 2H2O), который является балластом, снижающим концентрацию Р2О5 в продукте. Следовательно, для увеличения концентрации Р2О5 в суперфосфате нужно подобрать такую кислоту, чтобы при разложении ею природных фосфатов получался бы только монокальцийфосфат Са(Н2РО4)2 и не получалось бы других кальциевых солей.
Производство двойного суперфосфата. Для получения двойного суперфосфата, содержащего (помимо примесей, перешедших в него из сырья) только Са(Н2РО4)2, разлагают природные фосфаты фосфорной кислотой:
Са3(Р04)2 + 4Н3Р04 + n Н20 = 3 [Са(Н2РО4)2 · Н2О]
Двойной суперфосфат — концентрированное удобрение, содержащее 42—48% Р2О5; производство этого удобрения у нас в стране непрерывно возрастает.
Технологические процессы производства двойного суперфосфата и простого суперфосфата аналогичны. Так же как и простой суперфосфат, двойной суперфосфат подвергают гранулированию и аммонизации.
В процессах разложения фосфорного сырья, например апатитов Ca5F(PO4)3, кислотами (производства фосфорной кислоты, простого и двойного суперфосфатов) происходит выделение газов, содержащих фтористые соединения — HF, SiF4. Эти газы обрабатываются водой, при этом образуется кремнефтористоводородная кислота H2SiF6, которую перерабатывают в Na2SiF6, NaF и (NH4)2SiF6.
Производство преципитата СаНРO4·2Н2О. Процесс заключается в нейтрализации фосфорной кислоты известняком, а затем известковым молоком:
ЗН3РО4 + 2СаСО3 = Са НРО4 · 2Н2О + Са (Н2РО4)2 + 2СО2
Са (Н2РО4)2 + Са (ОН)2 = 2Са НРО4 · 2Н2О
Образовавшийся осадок преципитата отфильтровывают от раствора и сушат. Это удобрение содержит 42% Р2О5 в цитратнорастворимой форме. Сравнительно высокая стоимость единицы Р2О5 в преципитате ограничивает его производство.
Производство термофосфатов и плавленых фосфатов. Природные фосфаты переводят в усвояемое растениями состояние спеканием при 1200° С со щелочами, в результате которого получаются так называемые термофосфаты. Сплавлением фосфатов с силикатами получают плавленые фосфаты. Термофосфаты и плавленые фосфаты содержат 20—30 % Р2О5 в лимоннорастворимой усвояемой растениями форме и применяются на кислых почвах.
Удобрением, близким по составу к плавленым фосфатам, является томасшлак, получаемый при выплавке стали из чугуна с повышенным содержанием фосфора. Томасшлак содержит до 20% Р2О5 в лимоннорастворимой форме.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 2044; Нарушение авторских прав?; Мы поможем в написании вашей работы!