
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 7. Технология связанного азота
|
|
|
|
Контрольные вопросы к теме VI
«Технология серной кислоты»
1. Укажите основные области использования серной кислоты и олеума.
2. Почему в настоящее время в качестве серусодержащего сырья иcпользуется преимущественно сера, а не колчедан?
3. Чем отличаются технологические схемы производства серной кислоты из серы и из колчедана? Дайте объяснение.
4. С какой целью печной газ перед контактированием разбавляют воздухом?
5. В чем заключается специальная очистка печного газа, полученного обжигом колчедана?
6. Какие катализаторы используются в производстве серной кислоты? Приведите состав контактных масс БАВ и СВД.
| Ключевое значение технологии связанного атмосферного азота в производстве продовольствия. Альтернативные варианты перспективы решения связывания атмосферного азота. Структура современного производства аммиака из природного газа. Многоступенчатая схема приготовления и очистки азотоводородной смеси. Особенности циркуляционной схемы синтеза аммиака; физико-химические основы выбора оптимальных условий синтеза; катализаторы в производстве аммиака. Современная технологическая схема производства азотной кислоты. Технологические решения, способствующие высокому выходу продукта. Физико-химические основы и аппаратурное оформление процессов селективного окисления аммиака, оксидов азота и их абсорбции. |
Газообразный азот - одно из самых устойчивых химических соединений (веществ). Энергия связи в молекуле азота составляет 945кДж/моль. Как результат: азот элементарный нереакционноспособен. В атмосфере азот находится в свободном состоянии в огромных количествах. Подсчитано, что над 1га поверхности земли имеется ~ 80т азота.
Элементарный азот в клубнях некоторых растений вступает в реакцию с образованием аминокислот и белков. Но эти реакции катализируют ферменты, а необходимую энергию обеспечивает фотосинтез.
Некоторое количество азота переходит в биологически усвояемую форму в результате грозовых разрядов по реакции:
N2 + 02 → 2NO
Большинство организмов легче усваивает соединения азота со степенью окисления - 3.
Это α-аминокислоты R-CH2-NH2-COOH и их полимеры - белки. Однако скорость перевода в состояние окисления в естественных условиях слишком мала для поддержания требуемого количества связанного азота. В среднем половина необходимого для жизни азота возвращается через атмосферу за 108 лет (для кислорода - 3000 лет, углерод - 100 лет).
СХЕМА ПЕРЕРАБОТКИ ПГ НА СЖТ

Эти цифры показывают необходимость синтеза азотсодержащих соединений для использования их живыми организмами.
Кроме того, потребителями азотных соединений являются: военное дело (тринитротолуол - тол: ракетное топливо и т.д.), фармацея, химическая промышленность и с/х.
Решением проблем связанного азота являлась реакция синтеза аммиака, промышленное осуществление которой позволило создать сырьевую базу для многих азотсодержащих соединений.
Сырьем для получения продуктов азотной промышленности является атмосферный воздух и различные виды топлива.
В воздухе: 79% N2+ 21% O2 (по объему), N2 - сырье для получения NH3, цианидов и др.
Ресурсы атмосферного воздуха огромны, поэтому сырьевая база азотной промышленности определяется топливом. Топливо необходимо для получения водорода ил водородсодержащего газа.
Динамика структуры сырьевой базы синтетического аммиака
| Твердое топливо | 32,0 | 15,9 | 10,4 | 5,7 | 1,5 |
| Коксовый газ | 32,1 | 18,2 | 14,2 | 11,7 | 5,3 |
| Природный газ | 16,3 | 59,9 | 72,3 | 79,6 | 92,2 |
| Прочие | 19,3 | 6,0 | 3,1 | 3,0 | 1,0 |
Природный газ → основа на ближайшие десятилетия. Но по мере истощения мировых запасов нефти и газа, а также изменения цен на рынке будут приобретать твердые виды топлива.
Получение технологических газов
Синтез-газ - основа для получения аммиака, метанола и пр. Синтез-газ может быть получен из:
1) твердого топлива
Синтез-газ получают в газогенераторах водяного газа:
С + Н2О ↔ (СО + Н2) – Q – синтез-газ,
С + О2 ↔ СО2 + Q
Синтез-газ получают на стадии парового дутья. Необходимая температура достигается в стадии воздушного дутья. Полученный водяной газ содержит: 50-53% H2 и ~ 36% СО.
Для дальнейшего использования в производстве водяной газ необходимо очистить от сернистых соединений и провести конверсию
оксида углерода: СО + Н2О ↔СО2 + Н2+ Q.
Затем необходимо удалить диоксид углерод
- газификация в виде пыли
2) Синтез-газ из жидкого топлива
Получение синтез-газа из жидких топлив осуществляется в процессах высокотемпературной кислородной конверсии. По технологическим схемам переработки в синтез-газ жидкие топлива можно разделить на две группы:
1 группа – высокотемпературная кислородная конверсия тяжелых жидких топлив (мазут, крекинг-остатки и др.)
2 группа – кислородная конверсия легкие прямогонные дистилляты (нафта).
3) Синтез-газ из природного газа
Природный газ - основа производства аммиака и метанола. По используемому окислителю и технологическому оформлению можно выделить варианты получения водородсодержащих газов:
а) высокотемпературная кислородная конверсия
б) каталитическая парокислородная конверсия
в) каталитическая пароуглекислотная конверсия в трубчатых печах
Основные реакции:
СН4 + 0,5О2 ↔ СО + 2Н2 + 35,6 кДж
СН4 + Н2О ↔ СО + ЗН2 - 206кДж
СН4 + СО2 ↔2СО + 2Н2 - 248кДж
Одновременно протекает реакция: СО + Н2О ↔ СО2 + H2 + Q
Обязательные стадии
1. Очистка ПГ от сернистых соединений, которые являются каталитическими ядами и относятся к коррозионно-агрессивным вещества.

Как правило, применяют двухступенчатую сероочистку:
|
катализаторе (алюмоникельмолибденовом).
t=350-400°C, р=2-4МПа
C2H5SH +H2=H2S +C2H6
C6H5SH +H2=H2S +C6H6
2) Сероводород при t=400-410°C поглощается оксидом Zn
H2S + ZnO = ZnS + H2O
(при t° = 200-500°C реакция необратима, что обеспечивает высокую степень очистки)
Конверсия CH4
1) Паровая конверсия (конверсия водяным паром):
СН4+ Н2О ↔СО+ ЗН2 - 206кДж tο = 800°
2) Конверсия СН4 кислородом в две стадии:
а) СН4 + 0,5О2↔ СО + 2Н2 + 347кДж,
СН4 + 2О2 → СО2 + 2Н2О + 800кДж
б) СН4 + Н2О ↔СО + ЗН2 - 206кДж,
СН4 + СО2↔2СО + 2Н2-248кДж
3) парокислородная, парокислородновоздушная, паровоздушная конверсия (процесс называется парокислородным).
Блок-схема получения технологических газов
для синтеза аммиака
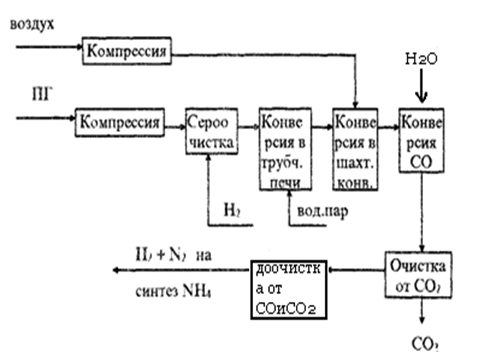

|
Блок-схема получения технологических газов для синтеза метанола
Катализаторы конверсии СН4
ГИАП-16 (алюмоникель магниевый)
25%-NiО; 57% - Аl2О3; 10%-СаО; 8% - MgO.
Конверсия оксида углерода Конверсия водяным паром:
СО + Н2О ↔СО2 + Н2 + Q
Широко используется в промышленности среднетемпературная конверсия на железо-хромовом катализаторе.
Очистка конвертированного газа от оксидов углерода
Очистка от СО2
- наиболее распространена – очистка раствором МЭА
R-NH2 + Н2О + СО2↔ (RNH3)2CO3 (карбонат)
(R-NH3)2CO3 + Н2О + СО2 ↔ 2RNH3HCO3 (бикарбонат),
где R (-OHCH2-CH2-)
Затем карбонаты и бикарбонаты при tο > 100°С диссоциируют с выделением CO2.
- очистка горячим активированным раствором К2СО3
К2СОз + СО2 + Н2О↔ 2КНСО3
Очистка газа от СО
Старый способ: очистка медноаммиачным раствором.
В настоящее время применяется метод промывки конвертированного газа жидким азотом, который растворяем СО, СН4, Аr.
Тонкая очистка от СО и СО2 проводится каталитическим гидрированием этих соединений до метана (метанирование)
СО + ЗН2↔СН4 + H2O + 206кДж
СО2 + 4Н2↔ СН4 + 2Н2О - 165кДж
Катализатор – никель- алюминиевый
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 795; Нарушение авторских прав?; Мы поможем в написании вашей работы!