
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимия. Термодинамика гальванического элемента
|
|
|
|
Гальванический элемент – это устройство, в котором полезная работа химической реакции превращается в работу электрического тока. С другой стороны, гальванический элемент – это устройство, состоящее из двух проводников I и II рода.
Проводник I рода – это вещество или материал, в котором переносчиками заряда служат электроны.
Проводник II рода – это вещество или материал, переносчиками зарядов в котором служат ионы.
С точки зрения термодинамики, любая химическая реакция может быть проведена таким образом, чтобы в результате её совершалась работа электрического тока. Для этого, общий химический процесс следует разделить на две полуреакции, в одной из которых будет протекать процесс окисления, а в другой - восстановления.
Исторически первым гальваническим элементом был элемент Якоби-Даниэля. В этом элементе протекает реакция: 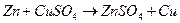 . При протекании данной реакции в обычных условиях, реакция не совершает полезную работу, а энергия рассеивается в виде тепла. В гальваническом элементе реакцию разделили на две части:
. При протекании данной реакции в обычных условиях, реакция не совершает полезную работу, а энергия рассеивается в виде тепла. В гальваническом элементе реакцию разделили на две части:

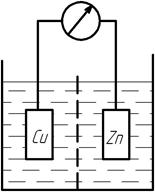
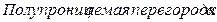
На медном электроде протекает процесс восстановления: 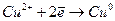
На цинковом – процесс окисления: 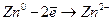
Если протекает процесс восстановления, на этом электроде он считается «+», если на электроде протекает процесс окисления, он считается «-».
Данные полуреакции разделены в пространстве, поэтому избыток электронов будет переходить на электрод с недостатком электронов.
Если рассматривать данный процесс с точки зрения термодинамики, проводник, соединяющий данные электроды должен иметь бесконечную длину или бесконечное сопротивление. В этом случае ток в электрической цепи будет бесконечно мал, а процесс будет протекать бесконечно медленно, то есть являться обратимым и квазиравновесным. Термодинамическое описание такого процесса будет настолько правильным, насколько внешнее сопротивление будет отличаться от бесконечно большого.
Используя понятие функции состояния, для которого изменение функции будет определяться начальным и конечным состоянием системы, можно использовать большинство термодинамических подходов и уравнений описания химического равновесия. В этом случае, изменение энергии Гиббса будет выражаться:
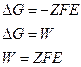
Е – ЭДС
F – Постоянная Фарадея
Z – Количество зарядов
Некоторые гальванические элементы соединяются не полупроницаемой мембраной, а солевым мостиком. Солевой мостик – это раствор сильного электролита, составляющие которого обладают одинаковой проводимостью.
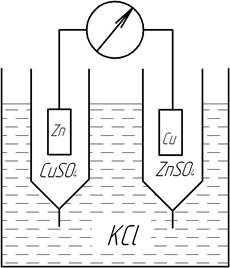
При использовании солевых мостиков формируется два диффузионных потенциала, которые близки по абсолютному значению, но направлены в противоположные стороны. Поэтому их взаимное влияние на ЭДС гальванического элемента взаимно уничтожается.
Наличие подобных солевых мостиков чаще всего усложняют схему гальванического элемента.
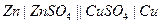
Зная ЭДС гальванического элемента и её зависимость от температуры можно рассчитать большинство термодинамических характеристик протекающей реакции, а так же вычислить КПД гальванического элемента и величину максимальной полезной работы:
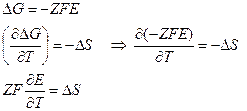
Если воспользоваться уравнением Гиббса-Гельмгольца, то:
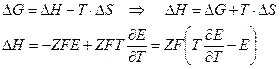
Величина 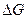 прямо пропорциональна максимальной полезной работе, которую может совершить химическая реакция.
прямо пропорциональна максимальной полезной работе, которую может совершить химическая реакция.
Величина 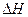 характеризует общий запас энергии в системе. Следовательно,
характеризует общий запас энергии в системе. Следовательно, 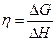 .
.
Оценим КПД гальванических элементов с различным значением температурного коэффициента.
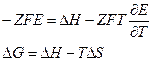
1. 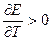 В этом случае ЭДС увеличивается с увеличением температуры.
В этом случае ЭДС увеличивается с увеличением температуры.
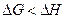
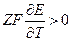
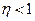
2. 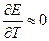 В этом случае
В этом случае 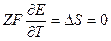
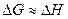
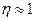
3. 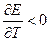 - ЭДС уменьшается с увеличением температуры.
- ЭДС уменьшается с увеличением температуры.
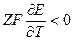
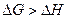
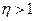
А теперь господа знатоки вопрос: почему для некоторых гальванических элементов работа больше общего запаса энергии?
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2220; Нарушение авторских прав?; Мы поможем в написании вашей работы!