
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы потенциометрии
|
|
|
|
Классификация гальванических элементов
Классификация электродов. Электродные процессы
Электроды I рода
Принципиальным отличием электрода I рода от всех остальных является в электродном процессе одного вида ионов. Чаще всего под электродами I рода подразумевают металлы, погруженные в раствор собственной хорошо растворимой солью, то есть раствор, содержащий катион металла.
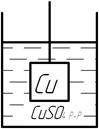
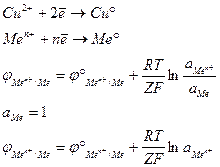
Поэтому электроды I рода считаются электродами, обратимыми относительно катионов. Для всех металлов, способных вытеснять водород из разбавленных кислот, электродный потенциал больше нуля, а для остальных – меньше нуля.
Из теории сильных электролитов известно, что 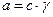 . Однако теория сильных электролитов и экспериментальные данные могут дать только среднеионные коэффициенты, которые относятся ко всему раствору в целом. Поэтому коррективный теоретический расчет электронных потенциалов в условиях, отличных от стандартных, невозможен.
. Однако теория сильных электролитов и экспериментальные данные могут дать только среднеионные коэффициенты, которые относятся ко всему раствору в целом. Поэтому коррективный теоретический расчет электронных потенциалов в условиях, отличных от стандартных, невозможен.
К электродам I рода следует отнести так же амальгамные электроды (амальгама – это раствор металлов в ртути). В данном случае запись электрода должна быть такой:
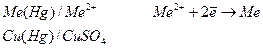
Конструктивно – это амальгама, погруженная в раствор, содержащий катионы, одноименные с катионом металла.
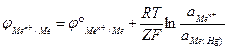
Данные электроды так же обратимы относительно катиона.
В отдельную группу выделяют газовые электроды, которые в некоторых случаях также относятся к электродам I рода, если в электродном процессе участвует всего один вид ионов. К таким электродам относят:
Водородный электрод: 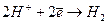
Хлорный электрод: 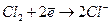
Конструктивными отличиями газовых электродов от электродов I рода является наличие границы раздела трех фаз: газ – жидкость - твердое вещество.
Поток газа проходит через раствор, содержащие ионы, одноименные с веществом газа, и электродный процесс протекает на инертном носителе. Общей формулы уравнения Нернста для газовых электродов не существует.
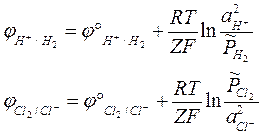
Поэтому говорят, что газовые электроды обратимы как относительно катионов, так относительно анионов.
Электроды II рода
На электродах данного вида в электродном процессе одновременно участвуют ионы двух типов. Поэтому эти электроды и получили свое название. Чаще всего электроды I рода рассматривают на примере хлорсеребряного электрода.
Конструктивно, электрод I рода – это металл, покрытый слоем труднорастворимого соединения и погруженный в раствор, содержащий анион, одноименный с ионами труднорастворимой соли.
В случае хлорсеребряного электрода, металл – серебро (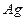 ), Труднорастворимая соль – хлорид серебра (
), Труднорастворимая соль – хлорид серебра (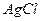 ), раствор – хлорид калия (
), раствор – хлорид калия (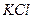 ).
).
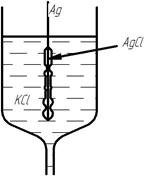
Процесс, протекающий на электроде, можно представить в виде совокупности двух реакций:
1. Восстановление металла:
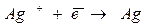
Так как раствор не содержит катионов металла, они получаются при диссоциации труднорастворимого соединения
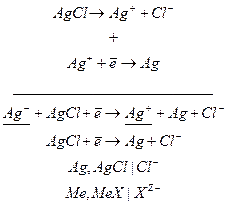
Уравнение Нернста для данного электрода:
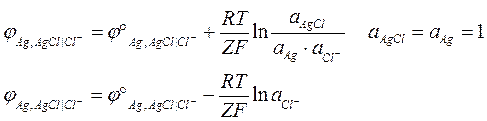
Исходя из уравнения Нернста, говорят, что электроды второго рода обратимы относительно анионов труднорастворимого соединения. Электродный потенциал электрода II рода связан с электродным потенциалом электродов I рода одноименного металла. Так как в реакции участвует катион, электродный потенциал электрода II рода может быть записан через стандартный электродный потенциал электрода I рода:
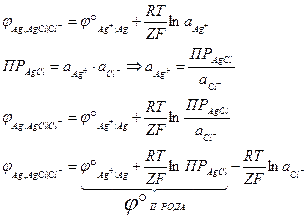
Стандартный электродный потенциал электрода II рода складывается из стандартного электродного потенциала электрода I рода и ПР труднорастворимого соединения.
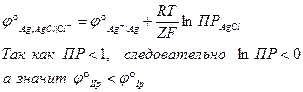
- если электроды сделаны из одноименных металлов.
Электроды II рода гораздо устойчивее электродов I рода, меньше подвержены воздействию окружающей среды. У них чаще всего наблюдается слабая зависимость потенциала от температуры более длительный срок службы. Однако, в большинстве случаев электроды II рода трудно реализуемы на практике.
Окислительно-восстановительные электроды
Абсолютно любой электрод может быть назван окислительно-восстановительным, так как на нем возможно протекание реакций окисления и восстановления. Однако, в отдельную группу выделяют электроды, на которых протекают реакции между ионами одинаковой природы но разной валентности. Например: 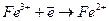
Конструктивно, данные электроды представляют собой инертный металл, погруженный в раствор, содержащий ионы разной валентности, но одинаковой природы.
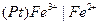
Уравнение Нернста такого электрода:
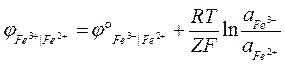
Данные электроды могут образовываться самопроизвольно, что будет приводить к процессу коррозии. Чаще всего подобные системы используют для предотвращения процесса коррозии, помещая в контакт активный металл.
Кроме того, в качестве окислительно-восстановительного электрода используют электроды с участием органических веществ. В частности, большое значение имеет хингидронный электрод.
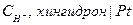
Хингидрон – это эквимолярное соединение хинона и гидрохинона.
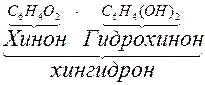
Гидрохинон – слабая кислота:
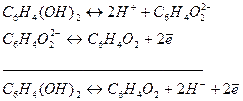
Уравнение Нернста для этого электрода:
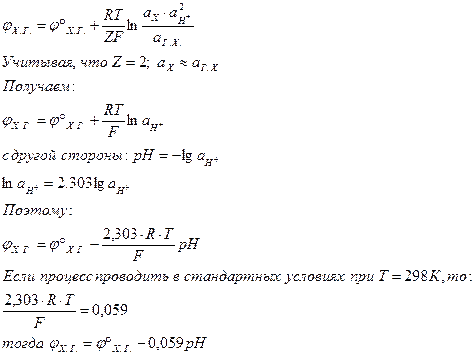
Во как!
Хингидронный электрод может быть использован для определения pH раствора.
При определении pH с хингидронным электродом используется любой электрод II рода. Как электрод сравнения, чаще всего используется хлорсеребряный электрод.
Хингидронный электрод очень прост и его потенциал устанавливается мгновенно. К недостаткам данного электрода следует отнести то, что он точно определяет pH только в кислых и слабощелочных средах. Это объясняется тем, что гидрохинон является слабой кислотой, и в присутствии щелочей у него резко меняется степень диссоциации. Кроме этого, хингидронный электрод нельзя использовать в присутствии окислителей и восстановителей.
Ионоселективные электроды
Эта особая группа электродов, электродный потенциал на которых возникает не за счет реакций окисления-восстановления, а за счет процессов диффузии. В результате протекания диффузии происходит обмен между ионами электрода и окружающей средой. Различные ионы имеют различную подвижность. Поэтому число ионов, перемещающихся с одной стороны, не будет равно числу ионов, приходящей с другой. На границе раздела двух сред возникает диффузионный потенциал. В гальванических элементах от него избавляются с помощью солевого мостика.
В ионоселективных электродах данный потенциал подлежит измерению.
Классическим примером такого электрода является стеклянный электрод:
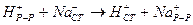
С точки зрения химии, изменение зарядов не происходит в этой реакции, но подвижность ионов водорода много больше подвижности ионов натрия, поэтому на поверхности стекла всегда будет формироваться потенциал.
Данная реакция будет характеризоваться константой равновесия:
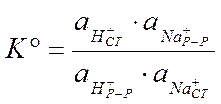
Константа равновесия зависит от температуры и природы реагирующих веществ, то есть будет определяться видом стекла.
Конструктивно, стеклянный электрод представляет собой серебряную проволоку, покрытую хлоридом серебра, помещенную в стеклянную капсулу, стенки которой и представляют собой поверхность электрода.
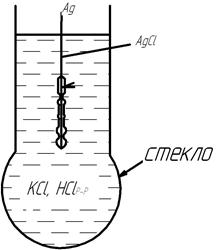
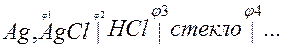
Общий потенциал будет равен сумме потенциалов на границе раздела: 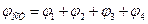
Поэтому он зависит от множества факторов. Чаще всего не определяют стандартный электродный потенциал, а калибруют их для условия эксперимента.
Ионоселективные электроды могут применяться в различных областях техники, прежде всего для неразрушающего контроля состава технологических жидкостей.
Лекция №13
План лекции:
1.Классификация гальванических элементов.
а) Гальванические элементы с переносом заряда.
б) Гальванические элементы без переноса заряда.
в). Концентрационные гальванические элементы с переносом заряда.
г). Концентрационные гальванические элементы без переноса заряда.
2. Основы потенциометрии.
а. Измерение ЭДС.
б. Измерение рН растворов потенциометрическим методом.
Гальванический элемент – это устройство, в котором полезная работа химической реакции превращается в работу электрического тока. Гальванический элемент, в котором работа совершается непосредственно за счет протекания в нем химических реакций, называется химическим.
Гальванический элемент, в котором работа совершается за счет разности концентраций, называется концентрационным.
Если оба электрода погружены в один и тот же раствор, элемент называется без переноса заряда.
Если электроды погружены в разные растворы, контакт между которыми обеспечивает полупроницаемая мембрана или солевой мостик, этот элемент называется с переносом зарядов.
Гальванические элементы с переносом заряда
Данный тип гальванических элементов является наиболее распространенным. В нем электроды имеют строгую полярность. Электрический ток вырабатывается за счет протекания реакций окисления-восстановления. Электроды соединены солевым мостиком, а возникающая ЭДС есть разность концевых потенциалов при условии, что внешняя цепь разомкнута.
Величина ЭДС подобных гальванических элементов, в первую очередь определяется разностью химических потенциалов материалов, составляющих электроды, или разностью стандартных электродных потенциалов.
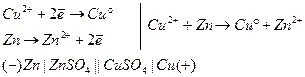
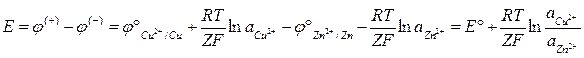
Данные гальванические элементы являются исторически первыми, однако обладают недостатками:
1. Недолговечны.
2. Чувствительны к присутствию посторонних веществ.
3. Обладают небольшой ёмкостью.
Гальванические элементы без переноса заряда
В основу данных гальванических элементов так же положена химическая реакция. Однако, оба электрода погружены в один и тот же раствор. Диффузионный потенциал при этом не возникает и солевой мостик не требуется, то есть отсутствуют факторы, препятствующие полному использованию энергии, заложенной в химической реакции.
Принципиальная схема такого гальванического элемента:
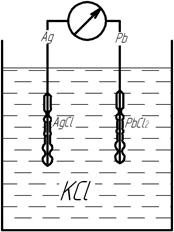
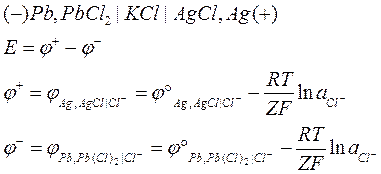
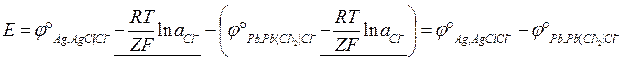
В данном случае, ЭДС гальванического элемента будет определяться стандартными электродными потенциалами отдельных электродов, а концентрация электролита не будет оказывать влияние на ЭДС гальванического элемента.
Наиболее известный гальваническим элементом без переноса заряда является нормальный элемент Веса, который представляет собой гальванический элемент, состоящий из двух электродов:
- Электрод I рода, содержащий амальгаму кадмия.
- Электрод II рода, содержащий сульфат ртути.
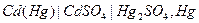
Основным преимуществом этого элемента является:
- Постоянство ЭДС (Е=1,01В)
- Маленький термический коэффициент:
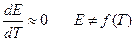
- Маленькое внутреннее сопротивление.
Недостатки:
- Нельзя переворачивать.
- Содержит ртуть.
Гальванические элементы без переноса заряда являются очень удобными, долговечными, но сложноисполняемыми технически, так как большинство труднорастворимых соединений аморфно и не может быть нанесено на металлические электроды.
Концентрационные гальванические элементы с переносом заряда
Данные гальванические элементы вырабатывают ток не за счет протекания в них химический реакций, а за счет выравнивания концентраций. Такие гальванические элементы состоят из электродов одной природы, но содержат электролиты разной активности. Например: 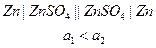
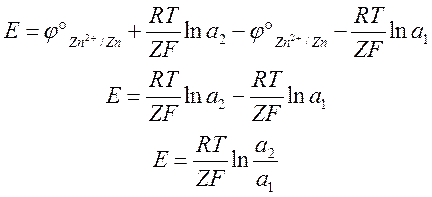
ЭДС подобных гальванических элементов будет определяться разностью концентраций электролитов соседних электродов. Однако, создать большую разность активностей не представляется возможным.
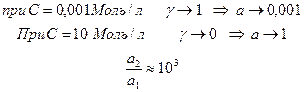
ЭДС подобных гальванических элементов очень мала и использовать их в практических целях для получения электрического тока очень затруднительно.
Концентрационные гальванические элементы без переноса заряда
Данный тип гальванических элементов является довольно экзотический, так как подразумевает одновременно наличие общего раствора и большую разность концентраций. Поэтому чаще всего такие гальванические элементы реализуются с помощью газовых электродов, в которых давление газа не одинаково.
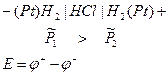
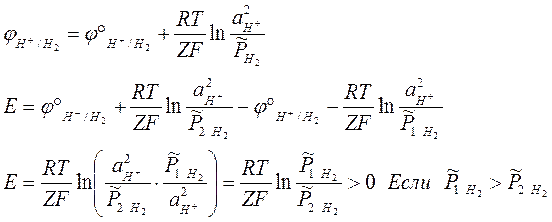
Чаще всего точный расчет ЭДС возможен в гальванических элементах без переноса заряда, так как именно в них можно избавиться от коэффициентов активности отдельных ионов и использовать понятие средней ионной активности.
Число гальванических элементов без переноса заряда ограничено, поэтому на практике используют гальванические элементы с переносом заряда, расчет ЭДС которых невозможен в принципе. Поэтому большое значение приобретают методы экспериментального определения ЭДС гальванического элемента.
Измерение ЭДС
В отличие от электродных гальванических потенциалов, измерение которых невозможно, ЭДС гальванических элементов поддается измерению.
Существует две основных группы методов измерения ЭДС:
1. Точный и долгий. Данный метод измерения проводится на основе компенсационного эффекта, то есть путем сравнения ЭДС неизвестного элемента с ЭДС известного элемента.
Для измерения ЭДС компенсационным методом необходимо как минимум: неизвестный гальванический элемент, известный гальванический элемент (с известной ЭДС), высокочувствительный гальванометр и реостат:
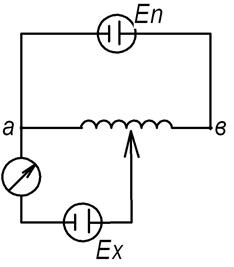 В данном случае гальванические элементы включены на встречу друг другу. Перемещая ползунок реостата, (меняя сопротивление) можно добиться полного отсутствия тока в цепи. Данное явление и будет называться компенсацией.
В данном случае гальванические элементы включены на встречу друг другу. Перемещая ползунок реостата, (меняя сопротивление) можно добиться полного отсутствия тока в цепи. Данное явление и будет называться компенсацией.
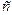 В простейшем случае:
В простейшем случае:
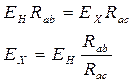
В этом случае ЭДС неизвестного элемента рассчитывается исходя из соотношения сопротивления участков ab и ac реостата.
Данные группы методов являются очень точными, но трудоемкими. Поэтому чаще всего используют другую группу методов
2. Приближенное измерение ЭДС быстро.
Данная группа методов использует специальные приборы – вольтметры.
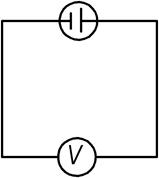
Сила тока согласно закону Ома 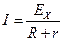
R – Сопротивление внешней цепи, определяемое вольтметром.
r – Внутреннее сопротивление гальванического элемента.
Чаще всего, вольтметр обладает большим сопротивлением.
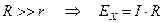
Измерение рН растворов потенциометрическим методом
Наиболее распространенным является измерение pH с помощью стеклянного электрода. В этом случае потенциал на границе стеклянного электрода:
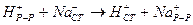
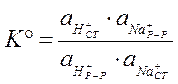
Чаще всего при выводе зависимости потенциала стеклянного электрода от концентрации ионов водорода в растворе используют обратную величину – константу обмена

Потенциал стеклянного электрода сложным образом зависит от концентрации ионов водорода, но, в общем, определяется формулой:
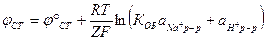
Стеклянные электроды чаще всего используют в паре с хлорсеребряным, который выступает в качестве электрода сравнения.
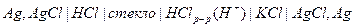
Для большинства ионоселективных электродов 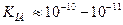 , поэтому
, поэтому 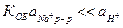
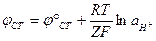
В стандартных условиях 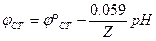
Если условия отличаются от стандартных, следует использовать температурную зависимость ЭДС.
В сильнощелочных растворах 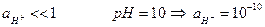 , поэтому
, поэтому 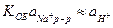
Измерение рН становится не точным, поэтому в сильнощелочных растворах используют электроды с усиленной натриевой функцией, то есть со специально повышенной константой обмена, чтобы выполнялось условие 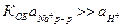
В этом случае 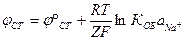
ПРОДОЛЖЕНИЕ СЛЕДУЕТ!!!
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2975; Нарушение авторских прав?; Мы поможем в написании вашей работы!