
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесные и стандартные электродные потенциалы
|
|
|
|
Основное уравнение электрохимии – уравнение Нернста
Исходя из положения классической термодинамики, для любой реакции применимо уравнение изотермы, которое в случае растворов должно быть, записано в виде:
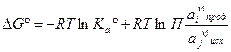
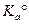 - термодинамическая константа равновесия, выраженная через активность.
- термодинамическая константа равновесия, выраженная через активность.
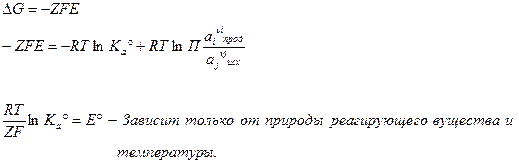
Формально, любая реакция является окислительно-восстановительной.
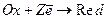
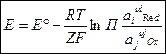
Данное уравнение чаще всего пишут в виде: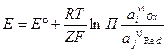 - уравнение Нернста. Данное уравнение является основным уравнением электрохимии.
- уравнение Нернста. Данное уравнение является основным уравнением электрохимии.
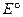 - стандартное значение ЭДС, численно равно
- стандартное значение ЭДС, численно равно 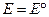 при
при 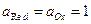 .
.
Уравнение Нернста позволяет проводить расчеты исходя из активности или парциальных давлений участников реакции, однако для любых расчетов требуется знание стандартной ЭДС гальванического элемента.
Классическая термодинамика позволяет дописывать в уравнение химического потенциала величины, которые отличают его от стандартных. Для растворов и окислительно-восстановительного процесса выражение для химического потенциала имеет вид:
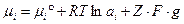 g – Потенциал в данной точке поля по отношению бесконечно удаленной точки в вакууме.
g – Потенциал в данной точке поля по отношению бесконечно удаленной точки в вакууме.
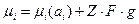
Если в химической реакции происходит растворение или кристаллизация вещества, условием равновесия будет являться равенство химического потенциала этого компонента на электроде и в растворе. 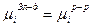
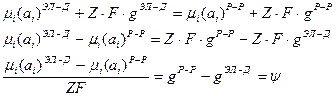
Величина 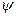 - гальванипотенциал. Он представляет собой разность потенциалов одного и того же компонента, находящегося в твердой фазе и растворе. Гальванипотенциал возможен между любыми материалами, входящими в состав различных систем. Однако, его истинное значение не известно и не может быть определено экспериментально, потому что всегда будет существовать хотя бы ещё один гальванипотенциал между материалом измерителя и измеряемого вещества.
- гальванипотенциал. Он представляет собой разность потенциалов одного и того же компонента, находящегося в твердой фазе и растворе. Гальванипотенциал возможен между любыми материалами, входящими в состав различных систем. Однако, его истинное значение не известно и не может быть определено экспериментально, потому что всегда будет существовать хотя бы ещё один гальванипотенциал между материалом измерителя и измеряемого вещества.
Для того, чтобы начать измерение электронных потенциалов требовалась система отчета. За начало отчета выбрали потенциал водородного электрода, а шкалу начали называть водородной шкалой.
Водородный электрод представляет собой платиновую пластинку, погруженную в одномолярный раствор соляной кислоты и омываемую газообразным водородом.
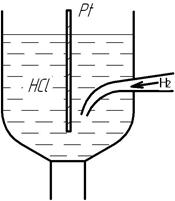 Давление водорода в водородном электроде должно быть равно единице. Потенциал этого электрода принимается равный нулю при любых температурах. Потенциал другого электрода, измеренного относительно водородного:
Давление водорода в водородном электроде должно быть равно единице. Потенциал этого электрода принимается равный нулю при любых температурах. Потенциал другого электрода, измеренного относительно водородного:
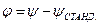
Разность двух гальванических потенциалов 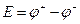
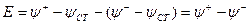
Таким образом, стало возможным определять ЭДС гальванического элемента экспериментально, а к отдельным электродам применять уравнение Нернста, так как в любом, случае даже отдельный элемент должен представлять собой
гальванический элемент, состоящий из стандартного водородного электрода и непосредственно самого электрода. В этом случае 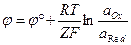 .
.
Лекция №12
План лекции:
1. Классификация электродов. Электродные процессы.
а) Электроды I рода.
б) Электроды II рода.
в) Окислительно-восстановительные электроды.
г) Ион-селективные электроды.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 773; Нарушение авторских прав?; Мы поможем в написании вашей работы!