
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура. Уравнение состояния идеального газа
|
|
|
|
Основное уравнение МКТ идеального газа
Идеальным называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые размеры. Взаимодействие молекул осуществляется только при столкновениях. Следствием многочисленных столкновений молекул газа со стенками сосуда, в котором он находится, является давление, оказываемое им на эти стенки. Это давление p можно рассчитать, если учесть, что давление численно равно силе, действующей на единицу площади стенки сосуда, или, согласно 2 закону Ньютона, среднему импульсу, передаваемому молекулами при соударениях в единицу времени единице площади: 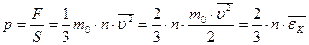 (1),
(1),
где S – площадь стенки, n – число молекул газа в единице объема (концентрация), 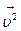 – средний квадрат скорости молекул,
– средний квадрат скорости молекул, 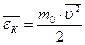 – средняя кинетическая энергия молекулы (2).
– средняя кинетическая энергия молекулы (2).
Уравнение 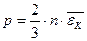 для давления называется основным уравнением МКТ (3).
для давления называется основным уравнением МКТ (3).
Понимание того, что такое температура пришло много позже введения единиц для измерения температуры как степени нагретости тела.
Шкалу температур от точки таяния льда (0°С) до точки кипения воды разделили на 100 частей и одну такую часть назвали 1 градус Цельсия (10С).
От 0°С шкалу температур такими же шагами (градусами) продлили вниз до точки, где кинетическая энергия поступательного движения молекул равна нулю, и назвали эту температуру абсолютным нулем. По Цельсию это – минус 273,150С. Кельвин предложил отсчитывать температуру от этой точки, а размер градуса сохранить. Тогда – 273,15°С будет соответствовать 0 градусов по Кельвину (0 К), а 0°С будет соответствовать 273,15 К. Под Т в дальнейшем понимается абсолютная температура в К.
Изучая разреженные газы Клапейрон открыл для них связь между термодинамическими параметрами в виде: p·V=C·T. Д.И.Менделеев показал, что коэффициент С в этом уравнении равен: С = ν· R =(m /μ)· R, где универсальная газовая постоянная R = 8,314 Дж/(моль·К) была определена опытным путем. Уравнение p·V=ν · R · T= (m /μ)· R · T = (N / N A)· R · T (4) называется уравнением состояния идеального газа или Клапейрона-Менделеева.
Умножим обе части уравнения (3) на объем V, занимаемый в данных условиях газом: 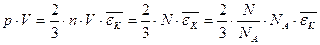 (5),
(5),
где n·V = N – число молекул в объеме V.
Сравнивая уравнения (4) и (5) получим: 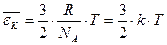 (6),
(6),
где к = R/NA представляет собой газовую постоянную в расчете на одну молекулу. Она называется постоянной Больцмана и равна
k = 8,314 /(6,02 · 1023)= 1,38·10 -23Дж/К (7).
Из (6) следует физический смысл температуры: она характеризует среднюю кинетическую энергию движения молекул. При приведении тел в соприкосновение молекулы сталкиваются друг с другом, обмениваясь энергией. В конце концов средние кинетические энергии молекул соприкасающихся тел выравниваются. Т.о., температура определяется как термодинамический параметр, который выравнивается у тел, приведенных в соприкосновение. На этом основано действие термометров – приборов для измерения температуры, которая после теплообмена становится одинаковой и у тела и у прибора.
Поскольку N/V=n – концентрация, а m /V=ρ – плотность газа, то из (4) можно получить формулы: p=n·k·T и 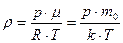 (8).
(8).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 547; Нарушение авторских прав?; Мы поможем в написании вашей работы!