
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Рассмотрим процесс расширения газа
|
|
|
|
Необратимые процессы
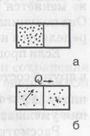 Рассмотрим процесс расширения газа. Пусть имеется сосуд с перегородкой (рис. а) в левой части которого есть газ, а в правой – нет. Уберем перегородку. Газ расширится и займет обе части. Если молекулы друг с другом не взаимодействуют (идеальный газ), то общая внутренняя энергия при таком процессе не изменится (UI =UII). Однако состояние II отличается от состояния I тем, что тело из состояния II самопроизвольно, без вмешательства извне не вернется в состояние I. Если молекул мало, например 2 или 3, то, двигаясь хаотически, случайно, они все могут в какой-то момент оказаться в левой части, но если молекул много, то это крайне маловероятно. Поэтому процесс расширения газа в пустоту называют необратимым.
Рассмотрим процесс расширения газа. Пусть имеется сосуд с перегородкой (рис. а) в левой части которого есть газ, а в правой – нет. Уберем перегородку. Газ расширится и займет обе части. Если молекулы друг с другом не взаимодействуют (идеальный газ), то общая внутренняя энергия при таком процессе не изменится (UI =UII). Однако состояние II отличается от состояния I тем, что тело из состояния II самопроизвольно, без вмешательства извне не вернется в состояние I. Если молекул мало, например 2 или 3, то, двигаясь хаотически, случайно, они все могут в какой-то момент оказаться в левой части, но если молекул много, то это крайне маловероятно. Поэтому процесс расширения газа в пустоту называют необратимым.
Другой пример: пусть газ находится и слева и справа от теплопроводной перегородки, но температура слева выше, чем температура справа (рис. б). Молекулы обмениваются с перегородкой кинетической энергией, и постепенно температуры обеих частей выравниваются. Такой процесс передачи тепла всегда необратим. Самопроизвольно средняя кинетическая энергия молекул (т. е. температура) слева сама не поднимется за счет кинетической энергии молекул справа.
Любой процесс, сопровождающийся трением, также необратим, так как при этом энергия упорядоченного движения переходит в энергию беспорядочного движения молекул, т. е. в теплоту.
Пусть с рабочим веществом совершаются циклы, при каждом из которых подводится от нагревателя Q1, отдается холодильнику Q2 и производится работа
А = Q1 – Q2. Из (38) и (39) можно получить:
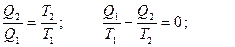 (40).
(40).
Величина Qi /Ti называется приведенной теплотой. Обозначим ее Δ Si. Из (40) следует, что сумма приведенных теплот при циклическом процессе равна нулю. Это означает, что, какой бы циклический процесс мы ни совершали, если мы вернулись в исходное состояние, некоторая величина S не меняется ( Δ S = 0). Следовательно, S – функция состояния. Она получила название энтропии. Таким образом, состояние определяется не только внутренней энергией U, но и энтропией S. Если процесс не циклический и тело переходит из состояния 1 в другое состояние 2, то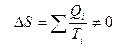 . Когда тело получает теплоту (Q > 0), его энтропия возрастает, когда теряет (Q < 0) – энтропия уменьшается. При адиабатическом процессе (Q = 0) ΔS = 0 и S=const, поэтому адиабатический процесс называют еще изоэнтропийным.
. Когда тело получает теплоту (Q > 0), его энтропия возрастает, когда теряет (Q < 0) – энтропия уменьшается. При адиабатическом процессе (Q = 0) ΔS = 0 и S=const, поэтому адиабатический процесс называют еще изоэнтропийным.
Рассмотрим теплопередачу при контакте двух тел при температурах Т1 и Т2 (Т1 > Т2) в теплоизолированной системе. Теплота Q, передаваемая телом 1, равна теплоте Q, полученной телом 2. Однако, тело 1 отдает ее при температуре Т1 и 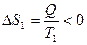 , а тело 2 получает ее при температуре Т2 и
, а тело 2 получает ее при температуре Т2 и 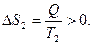 Так как Т1 > T2, следовательно, │Δ S 2│>│Δ S 1│, так что в целом при таком процессе энтропия возрастает. Т.о., при необратимых процессах энтропия увеличивается.
Так как Т1 > T2, следовательно, │Δ S 2│>│Δ S 1│, так что в целом при таком процессе энтропия возрастает. Т.о., при необратимых процессах энтропия увеличивается.
В тепловой машине часть теплоты, взятой от нагревателя, преобразуется в работу, а другая часть должна быть передана холодильнику. Нагреватель охлаждается, а холодильник нагревается.
С одной стороны, мы знаем, что при этом энтропия возрастает. С другой стороны, к.п.д. такой тепловой машины будет постепенно падать, так как  и при Т1 → T2 к.п.д. η → 0. Общая энергия системы, включающей нагреватель, холодильник, рабочее вещество и тело, над которым производится работа, остается неизменной, но работы получается все меньше и меньше. В пределе, когда Т1 = T2, теплота от нагревателя не может быть использована вовсе. Тогда внутренняя энергия нагревателя становится бесполезной. Таким образом, возрастание энтропии соответствует обесцениванию энергии.
и при Т1 → T2 к.п.д. η → 0. Общая энергия системы, включающей нагреватель, холодильник, рабочее вещество и тело, над которым производится работа, остается неизменной, но работы получается все меньше и меньше. В пределе, когда Т1 = T2, теплота от нагревателя не может быть использована вовсе. Тогда внутренняя энергия нагревателя становится бесполезной. Таким образом, возрастание энтропии соответствует обесцениванию энергии.
Энтропию можно связать со степенью упорядоченности системы. Увеличение энтропии соответствует увеличению беспорядка. Энтропия – это мера беспорядка. В наших примерах (рис.) система переходила из менее вероятного, упорядоченного, неравновесного состояния в более вероятное, неупорядоченное, равновесное.
Вычислим изменение энтропии для идеального газа, исходя из дифференциальных выражений для изменения энтропии и I начала термодинамики:
dS=δQ / T; 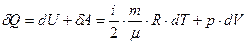 (41)
(41)
Учитывая, согласно уравнению Клапейрона, что 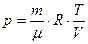 , и подставив p в δ Q, а δ Q в выражение для d S, получим:
, и подставив p в δ Q, а δ Q в выражение для d S, получим:
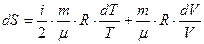 , которое после интегрирования определяет изменение энтропии идеального газа при переходе от состояния 1 с Т 1 и V 1 к состоянию 2 с Т 2 и V 2:
, которое после интегрирования определяет изменение энтропии идеального газа при переходе от состояния 1 с Т 1 и V 1 к состоянию 2 с Т 2 и V 2:  (42).
(42).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 706; Нарушение авторских прав?; Мы поможем в написании вашей работы!