
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость. Молярная теплоемкость газа. Степени свободы
|
|
|
|
Под теплоемкостью С телапонимают то количество тепла, которое надо сообщить телу, чтобы повысить его температуру на один градус Кельвина:
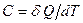 (Дж/К) (24)
(Дж/К) (24)
Если передается энергия не всему телу, а одному килограмму, то говорят об удельной теплоемкости с = С/m (Дж/(кг·К)). Если речь идет об одном моле, то говорят о молярной теплоемкости 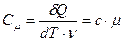 , измеряемой в Дж/(моль·К). О ней мы и будем говорить далее.
, измеряемой в Дж/(моль·К). О ней мы и будем говорить далее.
Поскольку при переходе тела из одного состояния в другое δQ зависит от процесса, по которому производится этот переход, теплоемкость тоже зависит от процесса. Если процесс изохорический (V = const), то теплоемкость обозначается СV. Если процесс изобарический, то – Ср. При изотермическом процессе dT = 0, a δQ не равно нулю и соответствующая теплоемкость устремляется к бесконечности СТ → ∞.
Определим СV (теплоемкость 1 моля при постоянном объеме), использовав первое начало термодинамики в дифференциальной форме (19).
Поскольку V = const, то dV = 0 и δA = 0 и для СV получаем:
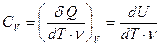 (25).
(25).
Значок вне скобок указывает на тип процесса, т. е. что V = const. Соотношение (25) означает, что при постоянном объеме все подводимое тепло идет только на изменение внутренней энергии U.
При изобарическом процессе (р = const), для теплоемкости Ср получаем:
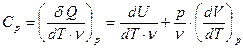 (26).
(26).
Найдем (dV/dT)p из уравнения Клапейрона (4):
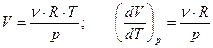 (27)
(27)
и подставив в (26), получим уравнение Майера: 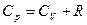 (28).
(28).
Cp больше, чем СV, так как подведенная теплота идет не только на увеличение внутренней энергии, но и на работу расширения газа.
Определим dU/dT, так как эта производная входит в (25) и (26). Для идеального газа внутренняя энергия равна сумме средних кинетических энергий всех N молекул: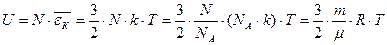 (29).Тогда
(29).Тогда 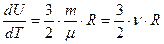 ;
; 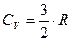 ;
; 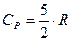 (30). В выражении для
(30). В выражении для 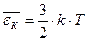 учитывалась только кинетическая энергия поступательного движения в трехмерном пространстве. Число независимых координат, необходимых, чтобы полностью определить положение тела в пространстве, называется числом степеней свободы i. Будем считать атомы, из которых состоит молекула, материальными точками, тогда одноатомная молекула имеет три степени свободы поступательного движения i = 3. И т.о., на каждую степень свободы приходится энергия по (1/2) kТ.
учитывалась только кинетическая энергия поступательного движения в трехмерном пространстве. Число независимых координат, необходимых, чтобы полностью определить положение тела в пространстве, называется числом степеней свободы i. Будем считать атомы, из которых состоит молекула, материальными точками, тогда одноатомная молекула имеет три степени свободы поступательного движения i = 3. И т.о., на каждую степень свободы приходится энергия по (1/2) kТ.
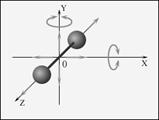 Если молекула двухатомная (рис.), то, кроме поступательного движения, она может еще вращаться вокруг осей x и y.
Если молекула двухатомная (рис.), то, кроме поступательного движения, она может еще вращаться вокруг осей x и y.
Вращение вокруг оси z не дает вклада в энергию, так как энергия вращательного движения равна J·ω2/2 = m·r2·ω2/2, а двухатомная молекула не имеет пространственной протяженности вдоль осей x и y.
Надо не только задать три координаты, чтобы определить положение центра масс молекулы в пространстве, но и задать еще две (вращательные) координаты, чтобы определить ее ориентацию в пространстве. Т.о., число степеней свободы для двухатомной молекулы i = 5.
Для трех- и более атомной молекулы вклад в энергию даст и вращение вокруг оси z. Для них i = 6.
Молекулы мы считали жесткими; колебательные степени свободы не
учитывались. Если их учесть, результат будет немного иной, но колебательные степени свободы становятся существенными только привысоких температурах.
Итак, для жестких молекул внутренняя энергия и молярные теплоемкости равны: 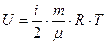 ;
; 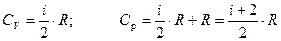 (31).
(31).
Все это сильно упрощенные рассуждения, непригодные, например, при очень низких или высоких температурах. Более последовательная теория теплоемкости строится на основе квантовой физики.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 627; Нарушение авторских прав?; Мы поможем в написании вашей работы!