
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация. Виды поляризации
|
|
|
|
Потенциал металлического электрода
Потенциал, который устанавливается на электроде при равновесии, называется равновесным потенциалом. Для его измерения нужен гальванический элемент следующего вида:
H2, Pt│H+││Men+│Me,
в котором протекает следующая токообразующая реакция:
Men+ +n/2H2 → Me + nH+
ЭДС этого элемента будет равна потенциалу металлического электрода по водородной шкале, т.к. потенциал водородного электрода равен 0:
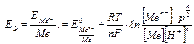 (5.8.)
(5.8.)
Поскольку [Н+] = 1, РН2 = 1, а у металлов концентрация равна 1, т.к. это твердые вещества, то
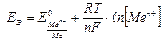 (5.9.)
(5.9.)
Уравнение (5.9.) называется уравнением Нернста. Переходя от ln к lg и подставляя во второе слагаемое Т = 298К и значения R и F, получим расчетную форму уравнения Нернста:
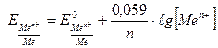 (5.10.)
(5.10.)
Стандартный электродный потенциал металла указывает на меру восстановительной способности его атомов и меру окислительной способности ионов металла. Чем более отрицательное значение имеет потенциал металла, тем более сильной восстановительной способностью он обладает. Чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы.
В общем виде уравнение Нернста
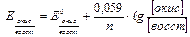 (5.11.)
(5.11.)
Фактическая электродвижущая сила гальванического элемента меньше теоретической. Причиной этого является поляризация.
Изменение потенциала электрода при прохождении через него электрического тока называется поляризацией:
ΔE = Ei ‒ Ep,
где Еi - потенциал электрода при прохождении тока; Ер — равновесный потенциал электрода.
Различают катодную DЕК и анодную DЕА поляризации.
Электрохимическая реакция протекает в три стадии:
1. Подвод реагентов к поверхности электрода.
2. Электрохимическая реакция.
3. Отвод продуктов реакции от поверхности электрода.
Если бы все три стадии протекали мгновенно, то потенциал электрода при прохождении через него тока не изменялся бы, и, поляризация была бы равна 0. Однако какая-то из этих стадий будет протекать с наименьшей скоростью и лимитировать скорость всего процесса. Стадия, определяющая скорость всего процесса, называется лимитирующей.
Наличие лимитирующей стадии обусловливает изменение потенциала электрода с целью увеличения скорости всего электрохимического процесса, т.е., приводит к возникновению поляризации электрода.
В зависимости от характера лимитирующих стадий процесса различают концентрационную, химическую и электрохимическую поляризации.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1344; Нарушение авторских прав?; Мы поможем в написании вашей работы!