
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая коррозия
|
|
|
|
Электрохимическая коррозия – разрушение металлов в электролите в процессе электрохимического взаимодействия. При электрохимической коррозии процесс взаимодействия включает анодное растворение металлов и катодное восстановление окислителя.
Анодное окисление металла: Ме – n e – Men+
Катодное восстановление: Ох + ne = Red
Окислителями являются О2, Cl2, ионы: H+, Fe3+, и т.д. Коррозия при участии кислорода называется коррозией с поглощением кислорода, а с участием водорода – коррозия с выделением водорода:
O2 + 2H2O + 4e → 4OH-
2H+ + 2e → H2
Вторичными реакциями при электрохимической коррозии являются взаимодействие ионов металлов с гидроксид ионами:
Меn+ + nOH- = Ме(OH)n
На рис.5.3. приведена схема химической и электрохимической коррозии металлов.
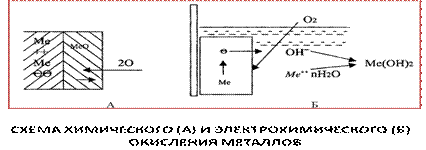
Рис.5.3.
Рассмотрим кислородную коррозию железа при наличии влаги. Кислород воздуха, растворяясь в водной пленке, образует растворы разной концентрации на различных участках поверхности. Участки металлов в растворе, насыщенном кислородом, являются катодами. Участки обедненные кислородом выполняют роль анода. Процесс коррозии описывается уравнениями:
На аноде: 2Fe – 4e = 2Fe2+
На катоде: O2 + 2H2O + 4e = 4OH-
В растворе: Fe2+ + 2OH- = Fe(OH)2
Окисление Fe(OH)2 под влиянием О2 воздуха продолжается
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
4 Fe(OH)3 разлагается с образованием следующих продуктов
4 Fe(OH)3 → 2 Fe2O3H2O + 4H2O
Смесь Fe(OH)3 и продукта его разложения называется ржавчиной.
Катодные и анодные участки чередуются и поэтому на поверхности металлов работает огромное количество коррозионных микроэлементов (или гальванопар) в которых происходят приведенные выше процессы (рис.5.4.).
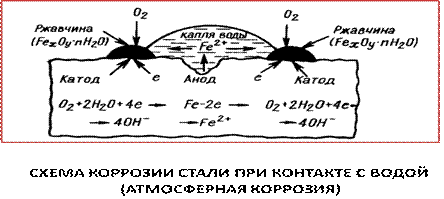
Рис. 5.4.
Коррозия в зависимости от потенциала металла может протекать по той или иной схеме.
1. Если потенциал металлов положительнее потенциала кислорода, то коррозия металлов невозможна. Потенциал золота положительнее потенциала кислорода при любой рН, поэтому золото не корродирует.
-3,04в 0 +1.23в +1.5в
Li____________________________ H2___________O2_______Au
3 2 1
2. Если же потенциал металла положительнее потенциала водородного электрода и отрицательнее кислородного электрода, то коррозия возможна с поглощением О2 и не возможна с выделением Н2.
3. Возможна коррозия как с поглощением О2, так и с выделением H2, если потенциал металла отрицательнее потенциала водородного электрода.
Большинство металлов корродирует с поглощением О2 при контакте раствора электролита с атмосферой.
5.4.3. Методы защиты от коррозии
Методы защиты металлов от коррозии делятся на следующие группы:
1. Легирование металлов;
2. Защитные покрытия;
3. Электрохимическая защита;
4. Изменение свойств коррозионной среды;
5. Рациональное конструирование изделий.
При легировании в состав сплава вводят компоненты, вызывающие пассивацию металлов. Легирующие компоненты окисляются быстрее, чем железо и образуют плотные защитные пленки оксидов.
Защитными покрытиями называется искусственно создаваемые на поверхности металлических изделий слои. Материалами могут быть металлы (Zn, Al, Cd, Ag, и др.), сплавы (бронза, латунь, мельхиор).
Катодные покрытия – это металлы, потенциалы которых в данной среде имеют более положительное значение, чем потенциал защищаемого металла (Cu, Ni, Ag). При повреждении покрытия основной материал становится анодом и растворяется, а материал покрытия – катодом, на котором выделяется H2 или поглощается О2.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал защищаемого металла, поэтому последний будет катодом и не корродирует.
Защита может осуществляться неорганическими и органическими покрытиями (эмали, лаки краски, полимерные пленки, эмалирование).
Электрохимическая защита основана на торможении анодных и катодных реакций и делится на катодную и протекторную.
При катодной защите конструкцию искусственно делают катодом путем наложения постоянного тока от внешнего источника. Анодом является стальной электрод, помещенный в ту же среду. Стальной электрод растворяется, на защищаемом сооружении (катоде) выделяется водород (рис.5.5.).
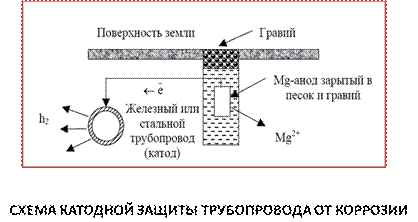
Рис. 5.5.
Протекторная защита заключается в образовании гальванической пары, в которой защищаемый металл играет роль катода, а анодом (протектором) служит более активный металлов. В качестве протектора используют металлы с низким потенциалом (Al, Mg, Zn). Протекторы соединяют металлическим проводом с защищаемой конструкцией.
Изменение свойств коррозионной среды сводится к снижению агрессивности среды. В нейтральной среде коррозия протекает с поглощением кислорода. Для удаления О2 производят деаэрацию (кипячение, барботаж инертным газом). Агрессивность среды можно уменьшить снижением концентрации ионов H+, т.е. подщелачиванием.
Для защиты от коррозии используют ингибиторы, вещества, при добавлении которых в среду, где находится металл, уменьшится скорость коррозии.
Рациональным конструированием изделий можно снизить коррозию, исключив наличие особо опасных участков в конструкциях (сварных швов, узких щелей и т.д.).
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 712; Нарушение авторских прав?; Мы поможем в написании вашей работы!