
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Совмещенные равновесия и конкурирующие процессы разных типов
|
|
|
|
Лекция 18
Сложные химические реакции в неорганической химии во многих случаях можно представить как последовательное протекание простых реакций. При таком подходе становится возможным рассчитывать термодинамические характеристики сложных реакций и прогнозировать их направление и глубину протекания как в стандартном состоянии, так и при произвольных концентрациях.
Число разных молекул и ионов, составляющих тело человека, по-видимому, еще не подсчитано. Все эти частицы делают потенциально возможным протекание гигантского количества химических превращений. Почти каждый вид частиц может участвовать во многих превращениях, и этим обусловлена возможность протекания конкурирующих процессов. Наряду с постоянно идущими химическими процессами в организме устанавливаются и равновесия, подверженные смещению. Отдельный вид частиц может одновременно участвовать в нескольких равновесиях, приобретающих достаточно сложный, многоступенчатый характер. Целью сегодняшней лекции является рассмотрение принципов анализа таких процессов и равновесий, и применения к ним методов термодинамики. Отчасти такой анализ нами уже проводился на примере однотипных конкурирующих процессов – протолитических, гетерогенных, лигандообменных. Напомню важнейшие формулы и уравнения, касающиеся констант равновесия, которые мы будем использовать.
D G ° = - RT ln K;
D G = RT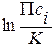
 ;
;
K S = П K i;

ln K о-в = 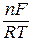 (j°ок - j°вос);
(j°ок - j°вос);
 ; c i = 1 – стандартное состояние.
; c i = 1 – стандартное состояние.
Совмещенные равновесия – это два или более равновесия, с общей участвующей в них частицей.
Рассмотрим реакцию карбоната кальция СаСО3 (известняка) с уксусной кислотой. Раньше такой опыт показывали в школе на естествознании:
 СаСО3 + 2СН3СООН Са2+ + 2СН3СОО– + СО2 + Н2О
СаСО3 + 2СН3СООН Са2+ + 2СН3СОО– + СО2 + Н2О
С упрощенных позиций школьной химии ее направление невозможно предсказать, так как слева в уравнении имеется осадок СаСО3 и слабый электролит СН3СООН, а справа тоже слабый электролит Н2СО3, распадающийся с выделением газа. Для прогнозирования реакции надо знать константу равновесия, но непосредственно в справочнике ее не найдешь, так как там даны константы для простых равновесий, а это совмещенное равновесие. Но совмещенное равновесие можно разбить на последовательные обратимые реакции:
 СаСО3 Са2+ + СО32–
СаСО3 Са2+ + СО32–
 СО32– + 2 Н+ Н2СО3
СО32– + 2 Н+ Н2СО3
 Н2СО3 СО2↑ + Н2О
Н2СО3 СО2↑ + Н2О
 СН3СООН СН3СОО– + Н+
СН3СООН СН3СОО– + Н+
В этих реакциях выделены частицы, участвующие в двух и более равновесиях. Здесь совмещены равновесия разных типов. Первое из них гетерогенное, далее два протолитических равновесия, и еще разложение неустойчивой угольной кислоты. Далее рассмотрим принципы подхода к анализу таких равновесий и расчета констант совмещенных равновесий. Пока же подробнее рассмотрим понятие конкурирующих процессов.
Конкурирующие процессы – это два или более термодинамически возможных превращения (DG° < 0), с одним или несколькими общими исходными веществами.
Ион серебра может окислять ионы иода (φº(Ag+/Ag) > (φº(I2/I–)), но вместо этого наблюдается образование желтого осадка иодида серебра:
 AgI↓; K =
AgI↓; K = 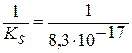 = 1,2×1016
= 1,2×1016
 Ag+ + I–
Ag+ + I–
Ag + ½I2; K = exp(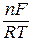 (0,80–0,54)) = 2,5×104
(0,80–0,54)) = 2,5×104
Из двух возможных процессов идет первый – образование осадка иодида серебра, так как константа равновесия этого процесса на много порядков величины больше, чем константа равновесия редокс-процесса.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 6618; Нарушение авторских прав?; Мы поможем в написании вашей работы!