
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовая модель
|
|
|
|
Квантовая или волновая механика основывается на том, что любые материальные частицы, имеющие массу, одновременно обладают волновыми свойствами. Однако двойственная природа характерна только для микрообъектов.
 Электрон имеет двойственную природу, проявляет свойства частицы и волны. Он имеет массу и заряд – это свойства частицы. Явления дифракции и интерференции говорят о волновых свойствах электрона. Особенности поведения электрона вызваны волновыми свойствами, т.к. волновое движение отличается от движения частиц. При описании движения волны не применяют понятие траектории. Поэтому для характеристики движения электрона вместо понятия "траектория" или "орбита" применяют вероятность нахождения электрона в данной точке атомного пространства. Т.е. электрон в атоме оказывается как бы "размазанным" по всему объему атома.
Электрон имеет двойственную природу, проявляет свойства частицы и волны. Он имеет массу и заряд – это свойства частицы. Явления дифракции и интерференции говорят о волновых свойствах электрона. Особенности поведения электрона вызваны волновыми свойствами, т.к. волновое движение отличается от движения частиц. При описании движения волны не применяют понятие траектории. Поэтому для характеристики движения электрона вместо понятия "траектория" или "орбита" применяют вероятность нахождения электрона в данной точке атомного пространства. Т.е. электрон в атоме оказывается как бы "размазанным" по всему объему атома.

 Часть атомного пространства, в котором вероятность пребывания электрона составляет свыше 90 % называют атомной орбиталью иобозначают или
Часть атомного пространства, в котором вероятность пребывания электрона составляет свыше 90 % называют атомной орбиталью иобозначают или
Электрон в атоме участвует в 2-х движениях – относительно ядра и имеет собственное движение. Поэтому для описания состояния электрона необходимо знать 4 параметра (4 числа).
1). Главное квантовое число (n) – характеризует энергию электрона. Это число равно любому положительному значению n = 1,2,3… . При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При
. При n = 1, электрон находится в самом низком энергетическом состоянии. С увеличением n энергия электрона возрастает, одновременно происходит удаление частицы от ядра. Т.е. наряду с энергией главное квантовое число характеризует орбитальный радиус. При  , энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
, энергия притяжения становится равной нулю, электрон отрывается от ядра. Происходит ионизация атома. Минимальная энергия, необходимая для отрыва электрона от атома, называется энергией ионизации. Эта величина характеризует электроотрицательность атома. Энергия ионизации уменьшается с возрастанием главного квантового числа и орбитального радиуса.
2). Орбитальное квантовое число (l) (побочное) – определяет форму атомных орбиталей, а также энергетические (орбитальные) подуровни главного энергетического уровня при данном n (главном квантовом числе). Орбитальное квантовое число l = 0,1,2…(n-1). Для каждого n орбитальное число принимает значение между 0 и (n -1).
При l = 0 – форма орбитали сферическая и называется s – орбиталью
При l = 1 – имеет форму гантели и называется р – орбиталью
При l = 2 – форма орбитали четырехлопастная и называется d – орбиталью
При l = 3 – форма орбитали шестилепестковая и называется f – орбиталью
| Главное квантовое число | орбиталь | Обозначение орбитали |
| n | n- l | |
| s | ||
| 0,1 | s, р | |
| 0,1,2 | s, р, d |
Для обозначения состояния электрона, главное квантовое число ставят перед символом побочного (орбитального) квантового числа. Например: 4s обозначает n=4; l = 0; 2р обозначает n=2; l = 1.
3) Магнитное (азимутное) квантовое число (m l) – характеризует направление (ориентацию) электронной орбитали (связанного с ним магнитного момента), а также число атомных орбиталей на энергетическом подуровне.
Магнитное квантовое число равно значению от – l до + l, включая 0, оно показывает число атомных орбиталей в данном подуровне, т.е. всего 2 l + 1. Например:
S – подуровень, где l = 0, m l = 1, содержит 1 S – орбиталь;
р – подуровень, где l = 1, m l = -1,0,+1, содержит 3р-орбитали, ориентрированные в пространстве по координатным осям x,y,z;
d - подуровень; l = 2, m l = -2,-1,0,+1,+2, содержит 5 d - орбиталей, симметрично ориентированных в пространстве
f – подуровень, где l = 3, m l = -3,-2,-1,0,+1,+2,+3, содержит (7) 7 f – орбиталей разных симметричных ориентации.
Таким образом, с помощью 3 квантовых чисел n, l, m l полностью описывается движение электрона вокруг ядра.
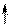

 4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение
4) Спиновое квантовое число – характеризует собственное вращательное движение электрона имеет значение  1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают
1/2, которое отвечает вращение по часовой и против часовой стрелки. Это вращение описывается понятием "спин". Его обозначают  . Электроны, находящиеся на одной орбитали, обладают противоположными спинами
. Электроны, находящиеся на одной орбитали, обладают противоположными спинами  , называются спаренными.
, называются спаренными.
Таким образом, состояние электрона в атоме полностью описывается с помощью 4-х квантовых чисел. Они характеризуют спин, энергию, объем, форму пространства, в котором вероятно пребывание электрона около ядра. При переходе атома из одного состояния в другое меняется квантовое число и перестраиваются электронные облака.
Дальнейшее изучение сложных атомов позволило понять основные принципы заполнения атомных орбиталей.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 924; Нарушение авторских прав?; Мы поможем в написании вашей работы!