
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Круговой процесс (цикл)
|
|
|
|
Уравнение политропы
pVn = const
где коэффициент п = 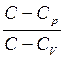 называется показателем политропы.
называется показателем политропы.
Значения теплоемкости и показателя политропы для разных процессов приведены в таблице.

Теплоемкость при изотермическом процессе бесконечно велика, поскольку dT=0, в то время как 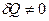 .
.
Теплоемкость при адиабатическом процессе равна нулю, поскольку 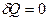 , в то время как
, в то время как 
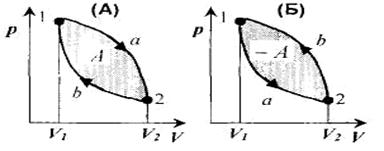
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На (p,V) -диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 - сжатию газа.
Работа расширения А1 положительна: A1 >0.
Работа сжатия отрицательна: А2 <0.
Работа за цикл А определяется площадью, охватываемой замкнутой кривой:
А = А1+А2
Таким образом, работа -это функция не только состояния термодинамической системы, но и вида процесса, который происходит. Поэтому работа не является однозначной функцией состояния (такой, как внутренняя энергия). Из первого начала термодинамики следует, что теплота Q, так же как и работа А, является функцией процесса, который происходит с системой.
Цикл называется прямым, если за цикл совершается положительная работа А =  pdV > 0 (цикл протекает по часовой стрелке - рисунок (А)).
pdV > 0 (цикл протекает по часовой стрелке - рисунок (А)).
Цикл называется обратным, если за цикл совершается отрицательная работа А = pdV < 0 (цикл протекает против часовой стрелки - рисунок (Б)).
pdV < 0 (цикл протекает против часовой стрелки - рисунок (Б)).
Прямой цикл используется в тепловых двигателях (совершают работу за счет полученной извне теплоты). Обратный цикл используется в холодильных машинах (за счет работы внешних сил теплота переносится к телу с более высокой температурой).
39. КПД кругового процесса.
В результате кругового процесса система возвращается в исходное состояние, следовательно, полное изменение внутренней энергии равно нулю. Поэтому Q=∆U+А=А, т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Если в ходе кругового процесса система не только получает количество теплоты Q1, но и теряет (отдает) количество теплоты Q 2,
то Q=Q1-Q2.
Термический коэффициент полезного действия для кругового процесса - это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой: 
40. Обратимый и необратимый процессы.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, теплопроводности и т.д.). Обратимые процессы - это физическая модель - это идеализация реальных процессов.
41. Энтропия.
Количество тепла δQ, которое должно быть доставлено системе или отнято у неё при переходе от одного состояния в другое, не определяется однозначно начальным и конечным состояниями, но существенно зависит от способа осуществления этого перехода (δQне является функцией состояния системы).
Однако, приведенное количество теплоты - отношение теплоты δQ к температуре Т системы при бесконечно малых изменениях состояния системы - есть функция состояния системы. В любом обратимом круговом процессе
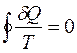
Следовательно, подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только начальным и конечным состояниями системы и не зависит от пути, каким система пришла в это состояние.
Энтропией S называется функция состояния системы, дифференциалом которой является δQ/T:

Т.о. первое начало термодинамики δ Q = dU + δА можно записать в виде
TdS = dU + δA,
откуда 
Функция F=U-TS является функцией состояния системы и называется энергией Гельмгольца или свободной энергией.
42. Изменение энтропии.
В замкнутой системе для обратимых процессов  ; для необратимых циклов ∆S >0.
; для необратимых циклов ∆S >0.
Неравенство Клаузиуса: энтропия замкнутой системы может либо возрастать (в случае необратимых процессов) либо оставаться постоянной (в случае обратимых процессов). 
Поскольку dS и δQимеют один и тот же знак, то по характеру изменения энтропии можно судить о направлении процесса теплообмена. При нагревании тела δQ>0и его энтропия возрастает dS>0, при охлаждении δ Q<0 и энтропия тела убывает dS < 0.
Изоэнтропийным называется процесс, протекающий при постоянной энтропии (S = const).
В обратимом адиабатическом процессе δQ= ТdS=0, так что dS=0 и S = const, поэтому адиабатический процесс является изоэнтропийным.
Рассмотрим для примера идеальный газ, который совершает равновесный переход из состояния 1 в состояние 2. Изменение его энтропии

используя dU = ;
; 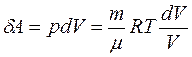 ;
; 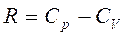 и
и 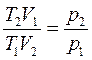


43. Статистическое толкование энтропии.
Термодинамическая вероятность W состояния тела или системы -это число способов, которыми может быть реализовано данное конкретное термодинамическое состояние (макросостояние). Иначе говоря, это число всевозможных микрораспределений частиц по координатам и скоростям (микросостояний), которыми может быть осуществлено данное макросостояние.
Формула Больцмана: S = k ln W
где k - постоянная Больцмана.
Энтропия системы определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Энтропия является мерой неупорядоченности системы, -чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия.
44. Принцип возрастания энтропии.
Все процессы в замкнутой системе ведут к увеличению её энтропии. В замкнутой системе идут в направлении от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной. В состоянии равновесия — наиболее вероятного состояния системы - число микросостояний максимально, при этом максимальна и энтропия.
45. Второе начало термодинамики.
Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Первое начало термодинамики выражает закон сохранения и превращения энергии применительно к термодинамическим процессам.
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие - нет.
Существуют ещё две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной
от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным
результатом которого является передача теплоты от менее
нагретого тела к телу более нагретому.
46. Третье начало термодинамики.
Третье начало термодинамики - теорема Нернста-Планка -постулирует поведение термодинамических систем при нуле Кельвина (абсолютном нуле): энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина.
Теплоемкости СV и Сp при Т = 0 К равны нулю, поскольку:
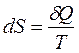 ,
, 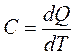 ,
,  , S(V=const, T) =
, S(V=const, T) =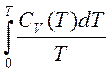
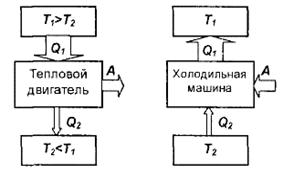
47. Тепловые двигатели и холодильные машины.
Тепловой двигатель — это периодически действующий двигатель, совершающий работу за счет полученной извне теплоты.
Термостатом называется термодинамическая система, которая может обмениваться теплотой с телами практически без изменения собственной температуры.
Рабочее тело — это тело, совершающее круговой процесс и обменивающееся энергией с другими телами.
Принцип работы теплового двигателя: от термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количе ство
ство
теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2, при этом
совершается работа A = Q1 –Q2,.
Термический КПД двигателя: 
Чтобы КПД был равен 1, необходимо, чтобы Q2=0, а это запрещено вторым началом термодинамики.
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине: от термостата с более низкой температурой Т2, за цикл отнимается количество теплоты Q2 и отдается термостату с более высокой температурой Т1, > Т2,. При этом Q = Q1 - Q2 = А или Q1 = Q2 + A
Количество теплоты Q1, отданное системой термостату Tt, больше количества теплоты Q2, полученного от термостата Тг на величину работы, совершенной над системой.
Эффективность холодильной машины характеризует холодильный коэффициент η' - отношение отнятой от термостата с более низкой температурой количества теплоты Q2 к работе А, которая затрачивается на приведение холодильной машины в действие:
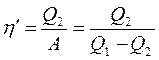
48. Теорема Карно
Из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей Т, и холодильников Т2, наибольшим КПД обладают обратимые машины. При этом КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
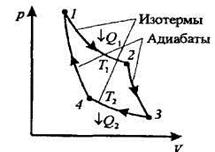
Наиболее экономичный обратимый круговой процесс, состоящий из двух изотерм и двух адиабат.
Рассмотрим прямой цикл Карно, в котором в качестве рабочего тела используется идеальный газ, заключенный в сосуд с подвижным поршнем.
Последовательные термодинамические процессы в цикле Карно
1-изотерма-2-адиабата-3-изотерма-4-адиабата-1:

А = А12+ A23+A34 + A41 =Q1+A23 - Q2+ A23 = Q1 – Q2
Для адиабат 2-3 и 4-1 уравнения Пуассона:  ,
, 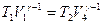 , откуда
, откуда
V1/ V2 = V3/V4.
Используя это, термический КПД цикла Карно:

действительно определяется только температурами нагревателя и холодильника.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 4112; Нарушение авторских прав?; Мы поможем в написании вашей работы!