
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы, жидкости и твердые тела
|
|
|
|
При рассмотрении реальных газов необходимо учитывать собственный объем молекул и силы межмолекулярного взаимодействия.
Силы межмолекулярного взаимодействия - короткодействующие - они проявляются на расстояниях менее 10-9м. Сила взаимодействия молекул - это равнодействующая сил притяжения F п(они преобладают на больших расстояниях) и сил отталкивания Fo (они доминируют на малых расстояниях). На расстоянии r=r0 эти силы уравновешивают друг друга и F=0. Таким образом, расстояние r 0 - это равновесное расстояние между молекулами, на котором бы они находились в отсутствие теплового движения.

|
Потенциальная энергия взаимодействия молекул U минимальна в состоянии устойчивого равновесия при r=r0.
Соотношение между Umin и кТ является критерием различных агрегатных состояний. Umin определяет работу, которую нужно совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии (r=г0). кТ определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы теплового движения молекул.
При U min «kT вещество находится в газообразном состоянии, т.к. тепловое движение молекул препятствует соединению (конденсации) молекул.
При Umin» кТ вещество находится в твердом состоянии, т.к. тепловой энергии недостаточно, чтобы "оторвать" молекулы друг от друга.
При U min ≈ кТ вещество находится в жидком состоянии, т.к. в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояния, превышающие r 0.
50. Уравнение Ван-дер-Ваальса.
Внесем в уравнение состояния идеального газа рVμ = RT поправки, учитывающие собственный объем молекул и силы межмолекулярного взаимодействия.

Фактический объем реального газа будет Vμ -b, где b - объем, занимаемый самими молекулами. Две молекулы радиуса rне могут сблизиться на расстояние меньше 2r, следовательно, для центров двух молекул недоступен сферический объем радиуса 2r. Этот объем b в восемь раз больше объема одной молекулы и в расчете на одну молекулу равен учетверенному объему молекулы.
Учет сил межмолекулярного притяжения осуществляется введением дополнительного давления р на газ, называемого внутренним давлением:
р'= a/ , где a - постоянная Ван-дер-Ваальса.
, где a - постоянная Ван-дер-Ваальса.
Уравнение Ван-дер-Ваальса для моля газа - уравнение состояния реальных газов: (р + a/ )(Vμ -b)= RT. Для произвольной массы газа:
)(Vμ -b)= RT. Для произвольной массы газа:
 , где
, где  ,
, 
51. Изотермы реальных газов.
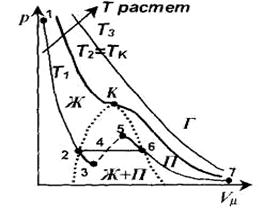
Изотерма реального газа представляет собой зависимость молярного объема газа от давления при постоянной температуре.
|
При высоких температурах (Т>Тk) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением формы.
При некоторой температуре Тк - критической температуре - на изотерме появляется точка перегиба К - критическая точка. Соответствующие этой точке объем Vk и давление рк называются критическими. Изотерма при Тк называется критической изотермой.
При Т <Тk уравнению Ван-дер-Ваальса соответствует кривая 1-2-3-4-5-6-7. Однако, на участке 5-3 сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы -
Фаза - совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии.
Истинные докритические изотермы реального газа имеют вид 1-2-6-7 и являются кривыми непрерывного Перехода вещества из газообразного состояния (Г) (участок 6-7) в жидкое (Ж) (участок 2-1). Участок 6-2 соответствует равновесному сосуществованию жидкости и газа.
Вещество в газообразном состоянии при температуре ниже критической называется паром (П), а пар, находящийся в равновесии со своей жидкостью, называется насыщенным (Ж + П). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ при температурах Т > Тк не может быть превращен в жидкость ни при каком давлении (Г).
При некоторых условиях могут быть реализованы метастабильные состояния 5-6 и 2-3. Участок 2-3 изображает перегретую жидкость, 5-6 — пересыщенный пар.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1813; Нарушение авторских прав?; Мы поможем в написании вашей работы!