
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. газы жидкости твердые вещества
|
|
|
|
Физические свойства
С2Н4, С3Н6, С4Н8 С5Н10 … С16Н32 C17H34 …
газы жидкости твердые вещества
Плохо растворимы в воде.
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Входящая в ее состав π-связь легко разрушается, и по месту разрыва могут присоединяться различные реагенты. Таким образом, для алкенов наиболее характерны реакции присоединения:
| |
 +XY ® – С – C –
+XY ® – С – C –
| |
X Y
| Тип, название реакции | Примеры реакций |
| I. Реакции присоединения 1. Гидрирование (образуются алканы) | СН2=СН—СН3 + Н2 ® СН3—СН2—СН3 пропен пропан |
| 2. Галогенирование (образуются дигалогеналканы) | СН2=СН2 + Cl2 ® Cl–CH2–CH2–Cl этен 1,2-дихлорэтан СН3–СН=СН–СН3+ Вг2 ® СН3–СН–СН–СН3 бутен-2 (H2O) | | Br Br 2,3-дибромбутан |
| Реакция с бромной водой (р-р Вг2 в Н2О) является качественной реакцией на алкены и другие непредельные УВ (бромная вода обесцвечивается). | |
| 3. Гидрогалогенирование (образуются галогеналканы) | СН2=СН2 + HCl ® СН3–CH2–Cl этен хлорэтан Br | СН2=СН–СН3 + НВг ® СН3–СН–СН3 пропен 2-бромпропан Последняя реакция протекает в соответствии с правилом Марковникова: при присоединении молекул типа НХ к несимметричным алкенам атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи. |
| 4. Гидратация (образуются предельные одноатомные спирты алканолы) | СН2=СН2 + НОН ® CH3–CH2–OH этен этанол СН2=СН–СН2–СН3 + НОН ® CH3–CH–CH–CH3 бутен-1 | OH бутанол-2 |
| II. Реакции окисления 1. Горение | С2Н4 + 3О2 ® 2СО2 + 2Н2О |
| 2. Неполное каталитическое окисление |
2СН2=СН2 + O2 ® 2 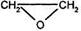 этиленоксид
этиленоксид
|
| 3. Окисление перманганатом калия в нейтральной или щелочной среде (образуются двухатомные спирты-гликоли) — реакция Вагнера | 3CH2=CH2+2KMnO4+ 4H2O®3CH2–CH2+2KOH+2MnO2¯ этилен | | OH OH Этиленгликоль или упрощенно: CH2–CH2 + (O) + H2O ® CH2–CH2 | | OH OH Используется как качественная реакция на алкены и другие непредельные УВ (р-р КМnО4 обесцвечивается). |
| 4. Окисление перманганатом калия в кислой среде (образуются карбоновые кислоты) — окислительное расщепление двойной связи | CH3–CH=CH–CH3 + 4(O) ® 2 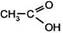 бутен-2 (из KMnO4) уксусная кислота
CH2=CH–CH3 + 4(O) ®
бутен-2 (из KMnO4) уксусная кислота
CH2=CH–CH3 + 4(O) ® 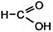 + + 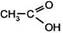 пропен (из KMnO4) муравьиная уксусная кислота
пропен (из KMnO4) муравьиная уксусная кислота
|
| III. Реакции полимеризации | n CH2=CH2 ® (–CH2–CH2–)n этилен(мономер) полиэтилен(полимер) n CH2=CH–CH3 ® (–CH2–CH–)n пропилен | CH3 Полипропилен |
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 394; Нарушение авторских прав?; Мы поможем в написании вашей работы!