
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вчення про валентність
|
|
|
|
У XVIII-му, а особливо в першій половині XIX ст. періодично перед вченими виникали проблеми, пов'язані зі здатністю одних атомів зв'язувати ту чи іншу кількість інших атомів, − те, що ми звично називаємо "валентність".
Нелегко викласти історію поняття валентності. Можна виокремити 4 періоди (за пропозицією італійського історика хімії Джуа).
1. Зародження вчення про валентність, 1850-1864 pp., праці Франкленда, Кекуле, Одлінга, Вюрца.
2. Структурна теорія − після 1861 p., яка пов'язана з працями Бутлерова, Ерленмейєра. Ідеться про теорію ароматичних сполук, вчення про ізомерію органічних сполук.
3. Координаційна теорія (1899-1907): А.Вернер, Тиле, Оддо.
4. Сучасна концепція − електронно-валентна, засновником якої стали Дж. Томсон, за ним Льюїс, Полінг, Гюккель та інші.
Саме поняття валентність введене Едуардом Франклендом (1825-1899), професором хімії різних закладів, у тому числі й Королівському інституті. Має дослідження в галузі теоретичної, прикладної та фізичної хімії. Вивчаючи склад металоорганічних сполук, учений зробив ряд важливих висновків щодо "зв'язуючої здатності" атомів елементів. Розглядаючи т. зв. змішані металоорганічні сполуки (або "парні сполуки"), він дійшов висновку, що це похідні неорганічних сполук, у яких еквівалент кисню (тобто "половина" атома кисню) заміщено на органічний радикал: HgJ2 амонію Hg(CH3)J. Проте Франкленд не згадує валентності Карбону, хоча дав визначення валентності інших елементів. Пізніше чотирьохвалентність вуглецю встановили Уїльямсон і, особливо, Кекуле. Останній указав на одновалентні: Н, СІ, Br, K; двовалентні О, S; тривалентні N, P, As; чотиривалентний Карбон (у метані, хлороформі тощо). Кекуле дав для вуглеводнів загальну формулу СnН2n+2. Проте у наступні роки виникли серйозні труднощі, пов'язані з установленням багатовалентності ряду елементів. Так, стали відомі пари РС13 − РС15; NH3 − NH4C1 та інші. Кекуле спробував обійти ці труднощі, називаючи перші сполуки атомними, або "справжніми" (де є справжні зв'язки між усіма атомами), і молекулярними, де ці зв'язки є не між всіма атомами. Останні варто би записувати РС13∙С12, та NH3∙НС1; NH3∙Н2S. Проте Кекуле вважав, що Карбон − завжди чотиривалентний, а для ненасичених вуглеводнів припускав, що 2 зв'язки залишаються незадіяними ("лакуна").
Немає можливості згадати всіх, хто зробив внесок в розв'язання проблеми валентності у другій половині XIX ст., тому зупинимося на найвидатніших фігурах. Щодо органічної хімії, то найбільший внесок зробив Тіле, який визнав існування подвійного зв'язку в ненасичених вуглеводнях, а в неорганічній хімії − Альфред Вернер,у застосуванні до комплексних сполук. А. Вернер (1866-1919) був професором хімії в Цюріху. Деякий час працював в області органічної хімії (нітропохідні, валентність вуглецю), а потім повністю віддався дослідженню координаційних сполук. 1913 року йому за ці праці була присуджена Нобелевська премія. Вернером написані "Підручник з стереохімії" та інші книги.
Вернер розвинув запропоновані раніше уявлення про атомні та молекулярні сполуки, ввівши (також раніше вже запропоновані) поняття головної та побічної валентності (або первинної та вторинної). Ці питання, в основному, розглянені в курсах неорганічної й аналітичної хімії, тому відзначимо лише основні положення теорії Вернера:
1. Постулюється різниця між головною та побічною валентністю.
2. Введено координаційне число та встановлено його максимальне значення.
3. Воно трактується як максимальне число груп, які можуть розташовуватись у сфері, яка оточує центральний атом.
4. Розроблено питання про розташування в просторі радикалів, безпосередньо пов'язаних з центральним атомом.
5. Розроблено питання про реакційну здатність груп і атомів, пов'язаних між собою.
Теорія Вернера дозволила дати просту класифікацію метал-амінів, різноманітних комплексів, які утворюються при проявленні вторинної (побічної) валентності атома кисню молекули води (гідрати солей, оснóвні солі), атома азоту молекули амоніаку. Так було показано, що вода в гідратах відіграє ту ж роль, що амоніак в аміакатах. Усе це стало значним внеском у пояснення теорії валентності.
У кінці XIX ст. отримали новий розвиток ідеї Деві та Берцеліуса про електрохімічну природу валентних сил. Найбільша заслуга тут Ріхарда Абегга (1869-1910) та Фрідріха Боулендера. Абегг був учнем Нернста, професор фізичної хімії в університеті Бреславля (тепер − Вроцлав). Зробив внесок у теорію розчинів і електролізу. Загинув молодим під час підйому на аеростаті.
Ці два вчені розробили теорію валентності, яка ґрунтується на 2-х основних поняттях.
Електроспоріднення − це споріднення атома до одиниці електричного заряду, тобто до електрона; електровалентність − то валентність, мірою якої є заряд іона. Кожен елемент володіє двома максимальними електровалентностями, однією позитивною, однією негативною, їх сума = 8. Кожен елемент проявляє одну нормальну валентність і одну так звану контрвалентність, перша більш типова. По групах це виглядає так
| Група | І | II | III | IV | V | VI | VII |
| Норм. валентність | +1 | +2 | +3 | +4 | -3 | -2 | -1 |
| Контрвалентність | -7 | -6 | -5 | -4 | +5 | +6 | +7 |
Зрозуміло, що цей підхід був уже значним наближенням до теорії іонного зв'язку, але остаточно це можна було завершити лише маючи точні дані про будову атома. Тим не менше, пошуки і розробки нових підходів продовжувались.
Першу теорію, що ґрунтувалася на електронній концепції, розробив Дж. Томсон у 1904 р. − він став творцем першої теорії будови − суцільного атома. З доповненнями, які ввів у 1912 р. Штарк, вона виглядає так. Валентність елемента визначається числом валентних електронів атома. Це є периферійні електрони. Валентне поле електропозитивне, якщо валентний електрон віддалений від поверхні свого (суцільного) атома на віддаль, що дорівнює, або більшу від діаметра самого атома, тобто ядра. Якщо ж ця віддаль менша, то валентне поле електронегативне (тобто здатне приєднувати електрон, отже, це неметал). З цієї концепції випливало, що валентність визначається числом електронів, які атом може віддати або приєднати під час хімічних реакцій.
Нарешті, після створення та підтвердження моделей будови атома Резерфорда (1911) та Бора (1913) Джон Льюїс висунув 1916 року теорію кубічного атома. За Льюїсом, групи з 2-х або 8-ми електронів на зовнішньому рівні атома дуже стійкі, тому атоми інертних газів дуже стабільні. Атом Не має 2 електрони, Ne − теж 2, але вони розташовані всередині куба, у вершинах якого 8 електронів. В Аr і наступних інертних газах все додається по одному більшому кубу з 8-ми електронів.
Розвиваючи теорію Льюїса, Ленгмюр розрізнив З типи валентності:
1. Позитивна валентність − число електронів, які атом може віддати.
2. Негативна − які атом може прийняти.
3. Ковалентність − число електронних пар, якими атом може володіти спільно з іншими атомами.
Уяву про електровалентність розвивав головно Коссель, основні її положення загальновідомі.
Починаючи з 20-х років поступово для пояснення хімічного зв'язку залучаються принципи квантової механіки (Гайтлер і Лондон, Полінг, Слейтер, Гунд.
Спочатку (40-50 pp.) домінувала т. зв. Теорія резонансу, коли допускалася можливість одночасного існування декількох валентних структур, які "резонують" (верхній ряд структур), тобто безперервно переходять одна в одну, наприклад для карбонат-іона. Зауважимо, що хоча ця теорія тепер не знаходить підтримки у вчених, вона зіграла позитивну роль при розробці теорії багатоцентрових зв'язків, як для іона СО32- (внизу):
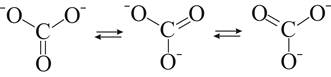
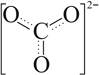
де кратність зв'язку (та його довжина) дорівнюють = 1⅓.
Цікаво, що в СРСР у 50-х роках з ідеологічних міркувань ("резонансні форми − це ідеалізм, є тільки одне щось") зазнали переслідувань учені, які цю теорію удосконалювали. Це значно загальмувало розвиток теоретичної хімії в СРСР.
Пізніше було запропоновано (і експериментально підтверджено) теорію молекулярних орбіталей, яка вам добре відома.
Усе ж, як на сьогодні, немає всеохоплюючої теорії хімічного зв'язку, і очевидно, що зв'язок у молекулах, між іонами є результатом природного потягу часток до зменшення своєї енергії, а поділ зв'язку на іонний, атомний, донорно-акцепторний і т.д. − дуже умовний і штучний.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 1353; Нарушение авторских прав?; Мы поможем в написании вашей работы!