
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Glucose
|
|
|
|
Глюкоза Глюкоза
C6H12O6∙H2O
Mm= 198,17
Получение. Глюкоза может быть получена гидролизом природных веществ, в состав которых она входит. В промышленности ее получают гидролизом картофельного и кукурузного крахмала кислотами.
Описание.
Белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворима в воде, мало в спирте, не растворима в эфире и хлороформе.
Глюкоза в водных растворах существует в нескольких таутомерных формах (α- и β-пираноз, α- и β - фураноз, открытой альдегидной форме), между которыми в растворах устанавливается равновесие:
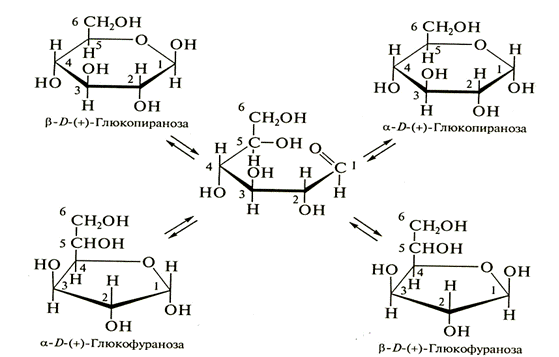
Среди 4 циклических форм D-глюкозы резко преобладает в растворе β- D-(+) глюкопираноза (64 %); содержание же альдегидной формы глюкозы в равновесной смеси составляет всего 0,024 %. Концентрация α- и β-глюкофураноз в смеси также ничтожна, все остальное количество глюкозы представлено α-аномером, В целом пиранозные (пираншестичленный цикл) формы резко преобладают над фуранозными (фуранпятичленный цикл) формами.
Реакции подлинности.
1.1.Удельное вращение 10 % раствора глюкозы является важной характеристикой для подтверждения подлинности глюкозы. Для определения удельного вращения препарат предварительно сушат при 100-1050С до постоянной массы. Измерение угла вращения производят после добавления к раствору препарата двух капель раствора аммиака. По углу вращения определяют удельное вращение (+ 52,30)
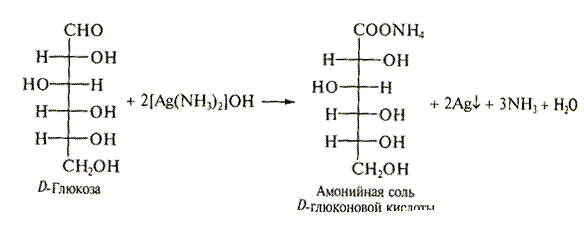
1.2. Реакции на альдегидную группу (окисления) с реактивом Толленса.
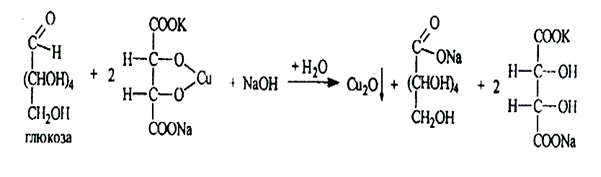
1.3. Реакция на альдегидную группу(окисления) с реактивом Фелинга происходит восстановление меди (II) до меди(I) Си20 – кирпично-красный осадок.
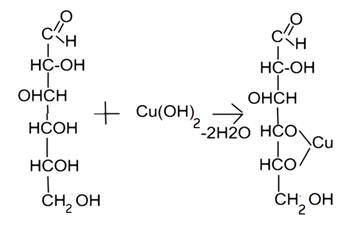
1.5. На спиртовые гидроксилы. Реакция комплексообразования. Реакцию проводят с раствором меди сульфата в щелочной среде.
1.6. При действии на глюкозу концентрированной серной кислотой или HCI, образуется фурфурол, который с каким либо фенолом(резорцином) образует красное окрашивание (ауриновый краситель)
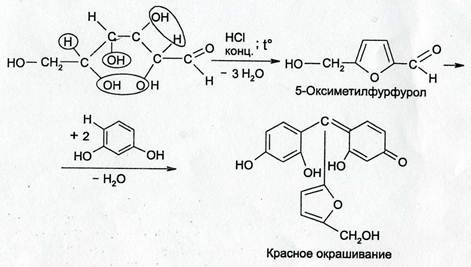
Испытание на чистоту.
Определяют прозрачность и цветность раствора, кислотность. В пределах эталона определяют хлориды, сульфаты, сульфатную золу, тяжелые металлы.. Не допускается примесь солей кальция, бария.
Количественное определение.
Метод иодометрии обратное титрование.
В основе метода лежит реакция окисления глюкозы стандартным раствором йода в щелочной среде. Избыток йода оттитровывют стандартным раствором натрия тиосульфата.
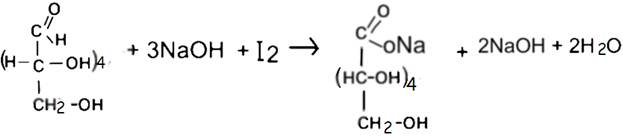
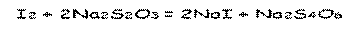
В аптечной практике готовят раствор глюкозы 5%. Количественное определение проводят по следующей методике.
1 мл раствора разводят дистиллированной водой до 10 мл. К 2 мл полученного раствора, помещенного в пробирку, прибавляют 2 мл 0,1 моль/л. раствора йода, 4 капли 10% раствора гидроксида натрия, закрывают пробирку пробкой и реакционную смесь оставляют стоять в темном месте 5 мин. Далее прибавляют 0,5 мл разведенной хлороводородной кислоты и титруют выделившийся йод 0,1 моль/л. раствором тиосульфата натрия. Параллельно проводят контрольный опыт.
1 мл 0,1 моль/л. раствора йода соответствует 0,009906 г (водной) глюкозы или 0,009006 г (безводной) глюкозы.
Раствор глюкозы 5%, 10%.20%, 40% определяют методом рефрактометрии. Определяют показатель преломления раствора.
Применение.
Применяют при различных заболевания сердца, печени, шоке, коллапсе в качестве источника легкоусвояемого организмом питания, улучшающего функции различных органов.
Хранение. В хорошо укупоренной таре, при комнатной температуре.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 26682; Нарушение авторских прав?; Мы поможем в написании вашей работы!