
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Защитные покрытия: металлические (анодные, катодные) и неметаллические. Химические покрытия
|
|
|
|
Защитные покрытия предохраняют изделия от коррозии и одновременно придают поверхности ценные свойства, такие как паяемость, отражательная способность, изностойкость. Защитные покрытия подразделяют на металлические и неметаллические
По механизму защитного действия металлические защитные покрытия подразделяют на катодные (коррозионно-стойкие) и анодные (протекторные). Металлы катодных покрытий имеют более положительные значения электродных потенциалов, чем значение потенциала металла, на который они нанесены. Например, серебряное (φ0 = 0,779 В) или никелевое (φ0 = -0,250 В) покрытие на железе (φ0 = -0,440 В). Такие покрытия защищают поверхность изделия лишь механически, поэтому основным требованием, предъявляемым к ним, является герметичность. В случае нарушения герметичности происходит разрушение металла с повышенной скоростью коррозии, вследствие возникновения и функционирования коррозионного гальванического элемента, в котором покрытие выступает в качестве катода.
Металлы анодных покрытий имеют более отрицательные значения потенциалов, чем потенциал металла, на который они нанесены. Поэтому цинковое (φ0 = -0,763 В) или алюминиевое (φ0 = -1,662 В) покрытие на железе (φ0 = -0,440 В) является анодным. Анодное покрытие защищает изделие не только механически, но и электрохимически. Это означает, что при повреждении покрытия, оно будет играть роль анода в образующемся в коррозионной среде гальваническом элементе и, следовательно, данное покрытие разрушаться не будет. Поэтому требование герметичности для анодных покрытий не существенно. Подвергаясь растворению в процессе эксплуатации изделия, анодное покрытие генерирует контактный ток, который, протекая между ним и изделием, катодно поляризует последнее, то есть смещает потенциал защищаемого металла в сторону меньших значений. Таким образом, поведение изделия с анодным покрытием аналогично механизму катодной защиты протектором. Поэтому анодное покрытие иногда называют протекторным.
Органические защитные слои. При консервации изделий применяется смазка неокисляющимися маслами (углеводороды, устойчивые к окислению). Масла наносятся при повышенной температуре (для улучшения смачивания, понижения вязкости). Застывая, образуется слой, защищающий металл от электролитной среды и воздуха. Особенно устойчива такая защита при добавлении в состав смазок ингибиторов. Неудобство консервирования смазкой состоит в необходимости удаления масла с поверхности металла при последующих операциях.
Лакирование — нанесение высокомолекулярных соединений, растворенных в летучем растворителе, на поверхность металла. После испарения растворителя на металле остается полимерный слой, не пропускающий окислитель и обладающий электроизоляционными свойствами. Лаки изготавливают из естественных смол (шеллак) или из синтетических полимеров (фенолальдегидные, глифталевые, силиконовые). При испарении растворителя могут образоваться поры в лаковом покрытии, и поэтому чаще всего употребляются многослойные покрытия, вероятность образования сквозных пор в которых значительно меньше.
Окраска металлических поверхностей сопровождается образованием полимера непосредственно на поверхности металла в процессе нанесения краски и ее отвердевании. Масляная краска представляет собой смесь частично окисленного масла (олифа) и пигмента-красителя. При нанесении краски тонким слоем на зачищенную до блеска поверхность металла, масло быстро окисляется кислородом воздуха и затвердевает, образуя на поверхности металла плотную пленку, которая и защищает металл от коррозии.
Нанесение полимеров на металл создает защитные слои с особыми свойствами (изолирующие, декоративные). Например, нанесение слоя резины на поверхность стали для изготовления различной химической аппаратуры. В настоящее время выпускается заводами готовая сталь с нанесенным полимерным слоем, которая является химически коррозионно-стойкой.
Защитные слои возможны с помощью оксидирования металлов. Оксидирование металлов сводится к созданию на поверхности металла слоя оксида, через который диффузия кислорода была бы ничтожно малой. Известны следующие методы нанесения оксидных слоев: термические, химические, электрохимические.
Электрохимическое оксидирование использует окислительные процессы на аноде электролизера. Обезжиренные и освобожденные от оксидных пленок изделия помещают на анод электролизера с окисляющим электролитом (SO 42-, Сr2О 7, СrО42-) и через очень короткое время изделие покрывается плотной оксидной пленкой:
на аноде: SO42- + H2O -2e → SO42- +2H+ +O
на катоде: Ме +О → МеО.
Фосфатирование металлической поверхности представляет собой процесс осаждения нерастворимых фосфатов этого металла. Сущность процесса фосфатирования сводится к усреднению дигидрофосфатов до фосфатов, нерастворимых в воде, за счет растворения поверхности металла:
Fe (Н2РО4)2 + 2Fc2+ → Fe3 (РО4}2 + 4Н+.
Нерастворимые фосфаты в виде мелких кристаллов прочно связаны с поверхностью металла. Однако покрытие получается пористое и может быть использовано как грунт для нанесения лакокрасочных покрытий, что широко используется в машиностроении и приборостроении.
Металлические защитные покрытия. Методы нанесения металлических защитных слоев на поверхность металлов весьма разнообразны, и их можно разделить условно на «горячие» или высокотемпературные и электрохимические.
Высокотемпературные методы. Метод окунания. Он применим для нанесения покрытий из легкоплавких металлов на более тугоплавкие. Так покрывают стальные листы оловом, цинком или свинцом. Сущность метода сводится к тому, что в расплавленный металл, из которого хотят приготовить покрытие, через слой флюса, закрывающий поверхность жидкого металла, погружают стальной лист и вынимают его также через слой флюса или масла для того, чтобы поверхность сразу не окислилась. Схема такого процесса показана на рис. 1. Цинк и олово в жидком состоянии хорошо смачивают поверхность стали. Для покрытия стали свинцом необходимо добавлять к нему некоторое количество олова, гак как свинец плохо смачивает стальную поверхность. Цинк, смачивая поверхность железа, взаимодействует с ним, образуя интерметаллиды (FeZп3, FeZn7), обладающие значительной хрупкостью. Поэтому процесс ведут быстро, с тем чтобы слой интерметаллидов был максимально тонким и не вызвал хрупкости всего защитного слоя. Олово растворяет железо с образованием твердого раствора, и интерметаллида FeSn2 обычно не образуется. Оловянный слой на луженом железе очень пластичен, так же как и свинцовый. Оценивая свойства луженого и оцинкованного железа, следует раздельно рассматривать механические
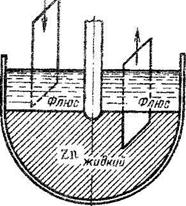
Рис. 1. Нанесение металлических покрытий окунанием.
свойства покрытия и его физико-химические свойства. Цинк по отношению к железу, представляет собой анод, и будет разрушаться в первую очередь сам, защищая железо от растворения, в то время как олово будет по отношению к железу катодом и повреждение покрытия вызовет усиленную коррозию железа.
Однако из этого не следует, что всегда оцинкованное железо лучше луженого, так как при этом получаются разные механические свойства нанесенного покрытия. В процессе цинкования между железом и цинком образуются хрупкие прослойки интерметаллидов, которые могут при перегибе листа дать трещины, приводящие к отслаиванию покрытия и его повреждению. При лужении железа слой олова получается пластичным, покрытие оказывается более прочным и выносит многократные перегибы листа без повреждения слоя.
Металлизация —это нанесение металлических покрытий на поверхность изделия распылением жидкого металла. Проволока металла, который наносится в качестве защитного слоя, подается в ацетиленокислородное пламя, в дуговой или плазменный разряд, при этом металл плавится и частично испаряется. Мельчайшие капли и пары металла струей газа транспортируются на поверхность изделия и соприкасаясь с ней, кристаллизуются. Поверхность изделия должна быть, тщательно очищена, так как иначе не будет прочного сцепления нанесенного слоя с металлом изделия.
Защитные слои можно создавать также вакуумным испарением. Покрытия, наносимые этим способом, не только защищают металл от коррозии, но и упрочняют его поверхность. Этот метод используют в ремонтно-восстановительных работах для наращивания изношенного слоя металла.
Плакирование — нанесение пленок защитного металла путем совместного проката. Метод приемлем только для листов и некоторых профилей проката (пруток, угольник).
Этот способ нанесения покрытий очень удобен, но при изготовлении из плакированного металла изделий встречаются технологические трудности. Сейчас наша промышленность выпускает дюраль и АМг-6, плакированные чистым алюминием, что значительно повышает коррозионную стойкость этих материалов. Выпускается также сталь, плакированная нержавеющей сталью (Х18Н10) и другие аналогичные материалы.
Электрохимические методы нанесения металлических покрытий основаны на электролизе. Металлические защитные слои в этом случае осаждаются на поверхности изделия, которое в электролизере представляет собой катод и находится под отрицательным потенциалом. Покрытие должно иметь мелкокристаллическую структуру и быть сплошным — без пор и трещин. Разработаны определенные режимы осаждения, обеспечивающие эти качества покрытий: температура, плотность тока и состав электролита. Для получения мелкозернистой структуры в состав электролита вводят поверхностно-активные вещества и органические добавки, препятствующие росту отдельных кристаллических зерен (например, декстрин, ализариновое масло).
Лекция 17. Конструкционные и электротехнические материалы.
Конструкционные материалы на основе легких и тяжелых металлов. Свойства конструкционных материалов, применяемых в технике. Электротехнические материалы: полупроводники, диэлектрики, проводники, сверхпроводники.
Конструкционные материалы на основе легких и тяжелых металлов. Свойства конструкционных материалов, применяемых в технике.
Под материалами понимают вещества, идущие на изготовление чего-либо или используемые при эксплуатации других веществ. Материалы, предназначенные для изготовления деталей машин и аппаратов, приборов, технических конструкций, подвергающихся механическим нагрузкам, называются конструкционными. Среди конструкционных материалов выделяют прочные, износостойкие, упругие, легкие, коррозионно-стойкие, жаропрочные. Материалы разделяют по магнитным, электрическим и другим свойствам.
Однако основы современной технике – машины и механизмы – изготовляют в основном из металлических материалов – металлов, сплавов металлов друг с другом и с некоторыми неметаллами.
В настоящее время сплавы железа подразделяют, на углеродистые стали, чугуны, легированные стали и стали с особыми свойствами.
Углеродистые стали – это сплавы железа с углеродом. В зависимости от содержания углерода в железе и температуры, получаются различные стали, отличающиеся микроструктурой. Такие стали обладают различными кристаллическими и механическими свойствами и могут превращаться одна в другую.
Твердое железо обладает способностью растворять в себе многие элементы. В частности, растворяется в железе и углерод. Его растворимость зависит от кристаллической модификации железа и температуры. Углерод растворяется в γ-железе гораздо лучше, чем в других полиморфных модификациях железа. Раствор углерода в γ-железе термодинамически устойчив в более широком интервале температур, чем чистое γ-железо. Твердый раствор углерода в α-, β-, δ-железе называется ферритом, твердый раствор углерода γ-железе – аустенитом.
Феррит является твердым раствором внедрения углерода в объемно-центрированную кубическую решетку железа. В связи с малыми расстояниями меду атомами железа в кристаллической решетке атомы углерода вынуждены размещаться в дефектах решетки (вакансиях, дислокациях).
Аустенит представляет собой фазу внедрения атомов углерода между атомами железа в гранецентрированной кубической решетке γ-железа. Но в связи с большим значением параметра кристаллической решетки γ-железа, чем у его остальных модификаций, содержание углерода значительно больше (до 2,14 % (масс.).
Другой фазой, образуемой железом и углеродом, является карбид железа, или цементит, Fe3C. Цементит имеет сложную кристаллическую структуру, содержит 6,67 % (масс.) углерода и характеризуется высокой твердостью (близкой к твердости алмаза) и значительной хрупкостью.
Механические свойства феррита и аустенита зависят от содержания в них углерода. Однако при всех концентрациях углерода феррит и аустенит менее тверды и более пластичны, чем цементит.
Железоуглеродные сплавы, содержащие меньше 2,14 % углерода, называются сталями, а содержащие больше 2,14 % углерода – чугунами.
Наиболее совершенный промышленный способ получения стали – плавка в электрических печах. Этим способом выплавляют в настоящее время большинство сортов специальных сталей. В электрической печи легко обеспечивается быстрый подъем и точное регулирование температуры, в ней можно создавать окислительную, восстановительную или нейтральную атмосферу. Это позволяет получать сталь с наименьшим количеством вредных примесей и заданного состава с высокой точностью.
При всех процессах выплавки жидкая сталь содержит небольшое количество растворенного кислорода (до 0,1 %). При кристаллизации стали, кислород взаимодействует с растворенным углеродом, образуя оксид углерода (II). Этот газ (а также некоторые другие растворенные в жидкой стали газы), выделяется из стали в виде пузырей. Кроме того, по границам зерен стали выделяются оксиды железа и металлических примесей. Все это приводит к ухудшению механических свойств стали. На качество стали, сильно влияют содержащиеся в ней газы (кислород, водород, азот) и вредные примеси (сера, фосфор). Кислород, азот и водород снижают пластичность и способствуют, хрупкому разрушению стали. Сера придает хрупкость стали при горячей обработке давлением (красноломкость), присутствуя в ней в виде сульфидов FeS. Крайне нежелательная примесь – фосфор, который вызывает хладноломкость: хрупкость стали при пониженных температурах. Сталь обыкновенного качества содержат до 0,015 % S и 0,045 % P, высококачественные стали содержат серы не более 0,015 %, а фосфора – не более 0,025 % масс.
Для удаления из сталей кислорода её еще в процессе получения, в жидком состоянии, подвергают раскислению. Раскисление – процесс удаления из жидкого металла кислорода добавлением марганца, кремния, алюминия, титана. Эти элементы активно связывают кислород, содержащийся в стали, в виде оксидов, которые переходят в шлак. Если кислород из стали не удалять, то при деформации при высоких температурах сталь подвергается хрупкому разрушению. Марганец также связывает серу в виде MnS и способствует, таким образом, устранению красноломкости стали:

Термической обработкой стали называется изменение ее структуры, а следовательно, и свойств, достигаемое нагреванием до определенной температуры, выдерживанием при этой температуре и охлаждением с заданной скоростью. Термическая обработка стали – важнейшая операция в технологии стали. Она может очень сильно изменить свойства стали. Ей подвергают как готовые изделия, главным образом инструменты и детали машин, так и полуфабрикаты, например, отливки. Применяются различные виды термической обработки, придающие стали различные свойства. Важнейшими являются закалка и отпуск.
Закалка – это нагревание стали до температуры, несколько превышающей температуру превращения перлита в аустенит. Закалка придает, стали твердость, прочность, но в то же время делает ее хрупкой. Поэтому закаленную сталь обычно подвергают еще одной операции – отпуску. Данная операция состоит в нагревании стали до температуры, при которой еще не достигается превращение в аустенит, выдержке при этой температуре и сравнительно медленном охлаждении. Отпуск – конечная операция термической обработки. В результате закалки и отпуска сталь получает требуемые механические свойства.
Механические свойства медленно охлажденной углеродистой стали, сильно зависят от содержания в ней углерода. Медленно охлажденная сталь состоит из феррита и цементита, причем количество цементита пропорционально содержанию углерода. Твердость цементита намного выше твердости феррита. Поэтому при увеличении содержания углерода в стали, ее твердость повышается. Кроме того, частицы цементита затрудняют движение дислокаций в основной фазе – в феррите. По этой причине увеличение количества углерода снижает пластичность стали.
Легированные стали. Элементы, специально вводимые в сталь в определенных концентрациях для изменения ее свойств, называются легирующими элементами, а сталь, содержащая такие элементы, называется легированной сталью. К важнейшим легирующим элементам относятся хром, никель, марганец, кремний, ванадий, молибден.
Различные легирующие элементы по-разному изменяют структуру и свойства стали. Так, некоторые элементы образуют твердые растворы в γ-железе, устойчивые в широкой области температур. Например, твердые растворы марганца или никеля в γ-железе при значительном содержании этих элементов стабильны от комнатной температуры до температуры плавления. Сплавы железа с подобными металлами называются, поэтому аустенитными сталями или аустенитными сплавами.
Феррит – твердый раствор внедрения углерода в кристаллическую решетку полиморфной модификации α-железа, в конструкционных сталях составляет не менее 90 % по объему. Он во многом определяет свойства стали. Легирующие элементы, растворяются в феррите и упрочняют его. Особенно сильно повышают твердость феррита Si, Mn и Ni, склонные к образованию иных кристаллических решеток, чем объемно-центрированная кубическая решетка α-Fe. Слабее влияют Mo, W, Cr, изоморфные α-Fe. Наиболее ценным и дефицитным легирующим элементом является никель. Вводя никель в сталь в количестве от 1 до 5 %, добиваются уменьшения порога перехода в хрупкое состояние стали на 60-80 0С и более.
По своему назначению стали делятся на конструкционные, инструментальные и стали с особыми свойствами. Конструкционные стали применяются для изготовления деталей машин, конструкций и сооружений. В качестве конструкционных, могут использоваться как углеродистые, так и легированные стали. Конструкционные стали обладают высокой прочностью и пластичностью. В то же время они должны хорошо поддаваться обработке давлением, резанием, хорошо свариваться. Основные легирующие элементы конструкционных сталей – это хром (около 1 %), никель (1-4 %) и марганец (1-1,5 %).
Марганцовистая сталь, содержащая до 15 % Mn, обладает высокими твердостью и прочностью. Из нее изготовляют рабочие части дробильных машин, шаровых мельниц, железнодорожные рельсы.
Инструментальные стали – это углеродистые и легированные стали, обладающие высокой твердостью, прочностью и износостойкостью. Их применяют для изготовления режущих и измерительных инструментов, штампов. Необходимую твердость обеспечивает содержащийся в этих сталях углерод (в количестве от 0,8 до 1,3 %). Основной легирующий элемент инструментальных сталей – хром, иногда в них вводят также вольфрам и ванадий. Особую группу инструментальных сталей составляет быстрорежущая сталь, сохраняющая режущие свойства при больших скоростях резания, когда температура рабочей части резца повышается до 600-700 0С. Основные легирующие элементы этой стали – хром и вольфрам.
Стали с особыми свойствами. К этой группе относятся нержавеющие, жаростойкие, жаропрочные, магнитные и некоторые другие стали. Нержавеющие стали устойчивы против коррозии в атмосфере, влаге и в растворах кислот, жаростойкие – в коррозийно-активных средах при высоких температурах. Жаростойкие стали сохраняют высокие механические свойства при нагревании до значительных температур, что важно при изготовлении лопаток газовых турбин, деталей реактивных двигателей и ракетных установок. Важнейшие легирующие элементы жаропрочных сталей – это хром (15-20 %), никель (8-15 %), вольфрам. Жаропрочные стали принадлежат к аустенитным сплавам.
Магнитные стали используют для изготовления постоянных магнитов и сердечников магнитных устройств, работающих в переменных полях. Для постоянных магнитов применяют высокоуглеродистые стали, легированные хромом или вольфрамом. Они хорошо намагничиваются, и длительное время сохраняют остаточную индукцию. Сердечники магнитных устройств изготавливают из низкоуглеродистых (менее 0,005 % С) сплавов железа и кремния. Эти стали легко перемагничиваются и характеризуются малым значением электрических потерь.
К чугунам относят сплавы железа с углеродом, содержащие более 2,14 % углерода. Различают чугуны: белые, серые, высокопрочные и ковкие. Чугун отличается от стали своими свойствами. Он в очень малой степени способен к пластической деформации, но обладает хорошими литейными свойствами. Чугун дешевле стали. В зависимости от условий кристаллизации, чугун может содержать углерод в виде цементита, графита или в виде их смеси. Форма образующегося графита также может быть различной.
Белый чугун содержит весь углерод в виде цементита. Из-за большого содержания углерода (6,69 % (масс.)) белые чугуны характеризуются высокой твердостью, хрупкостью. Поэтому в качестве конструкционного материала белые чугуны применяются в виде белого упрочняющего слоя на поверхности серого чугуна для изготовления прокатных валков, лемехов плугов, тормозных колодок и др.
В сером чугуне углерод содержится главным образом в виде пластинок графита. Эти низкопрочные пластинчатые включения углерода пронизывают металлическую основу материала и служат центрами разрушения серого чугуна при растяжении. Это влияние графита гораздо меньше сказывается при сжатии чугуна. Поэтому прочность чугуна при сжатии примерно в четыре раза больше прочности при растяжении. Поэтому серый чугун применяют при изготовлении деталей, работающих на сжатие, или для ненагруженных деталей (станины станков, корпуса редукторов и насосов, поршневые кольца двигателей и др.).
Высокопрочный чугун содержит графит в шаровидной (глобулярной) форме в интервале 3,0-3,6 %. Для этого в чугун вводят магний (до 0,08 %). Шаровидный углерод меньше снижает прочность чугуна, чем пластинчатый. Такие чугуны дешевле сталей и их часто применяют для замены стальных деталей и конструкций. Из высокопрочного чугуна изготавливают коленчатые валы, крышки цилиндров, детали прокатных станков, прокатные валки, насосы, вентили.
Медные и другие сплавы.
Латуни содержат медь до 45 % цинка. Различают простые и специальные латуни. В состав последних, кроме меди и цинка, входят другие элементы, например, железо, алюминий, олово, кремний. Латуни находят разнообразное применение. Из них изготавливают трубы для конденсаторов и радиаторов, детали механизмов, в частности часовых. Некоторые специальные латуни обладают высокой коррозийной стойкостью в морской воде и применяются в судостроении. Латунь с высоким содержанием меди – томпак – благодаря своему внешнему сходству с золотом используется для ювелирных и декоративных изделий.
Медноникелевые сплавы подразделяются на конструкционные и электротехнические. К конструкционным относятся мельхиоры и нейзильберы. Мельхиоры содержат 20-30 % никеля и небольшие количества железа и марганца, а нейзильберы содержат 5-35 % никеля и 13-45 % цинка. Благодаря стойкости против коррозии в воде, в том числе морской, конструкционные медноникелевые сплавы получили широкое распространение в судостроении и в энергетической промышленности. Из них изготавливают радиаторы, трубопроводы, дистилляционные установки для получения питьевой воды из морской.
Сплавы на основе никеля можно разделить на жаропрочные, магнитные и сплавы с особыми свойствами. Жаропрочные сплавы никеля используются в современных турбинах и реактивных двигателях, где температура достигает 850-900 0С. К важнейшим жаропрочным сплавам никеля относятся нимоник, инконель, хастеллой. В состав этих сплавов входит свыше 60 % никеля, 15-20 % хрома и другие металлы. Производятся также металлокерамические жаропрочные сплавы, содержащие никель в качестве связующего металла. Эти сплавы выдерживают нагревание до 1100 0С. К сплавам никеля с особыми свойствами принадлежат монель-металл, никелин, константан, инвар, платинит. Монель-металл (сплав никеля с 30 % меди) широко используется в химическом аппаратостроении, так, как по механическим свойствам он превосходит никель, а по коррозийной стойкости почни не уступает ему.
Износостойкие материалы.
Одним из необходимых условий создания износостойкого материала является обеспечение высокой твердости его поверхности. Такими свойствами обладают многие карбиды металлов. Карбиды металлов входят в составы сплавов карбидообразующих элементов (Cr, W, Ti) с углеродом (до 40 % С). Их применяют для изготовления литых и наплавочных материалов.
Упрочнения поверхности стали можно добиться специальными методами, такими как поверхностной закалкой с нагревом токами высокой частоты и химико-термической обработкой в виде цементации и азотирования. Цементация и азотирование – процессы диффузионного насыщения поверхностного слоя детали углеродом и азотом, соответственно. Данной обработке подвергают такие детали машин и аппаратов, которые должны иметь износостойкую рабочую поверхность и вязкую сердцевину (зубчатые колеса, коленчатые валы, кулачки, червяки).
Легкие конструкционные материалы. Для современной техники характерно снижение массы машин, аппаратов, приходящиеся на единицу используемой мощности. Для этого используют материалы с высокой удельной прочностью. Удельная прочность – отношение прочности материала к его плотности.
Современные материалы, применяемые в автомобилях, судах, авиации, космической технике, должны обладать большой удельной прочностью и достаточной пластичностью. Однако большинство пластичных материалов не обладает термической прочностью, а высокопрочные материалы – недостаточно пластичны.
В качестве конструкционных материалов из легких металлов применяются только Be, Mg, Al, Ti и сплавы на их основе. Данные металлы являются химически стойкими веществами, благодаря наличию плотных защитных оксидных слоев.
Сплавы на основе бериллия и магния обладают наряду с малой плотностью ценными упруго-прочностными свойствами. Бериллий обладает, прочностью легированной стали, а его удельная прочность одна из наивысших среди металлов. Бериллий является одним из лучших материалов для изготовления жестких и легких конструкций. Главными недостатками бериллия являются хрупкость, высокая стоимость и токсичность.
Прибавка к магнию небольших количеств других металлов существенно улучшает его твердость, прочность и сопротивляемость к коррозии. Достоинством магниевых сплавов является их малая плотность, составляющая 1,8 г/см3. Они используются в ракетной технике, в авиастроении, при изготовлении автомобилей, мотоциклов, приборов. Недостатком сплавов магния являются низкая стойкость против коррозии во влажной атмосфере и, особенно в морской воде.
Сплавы алюминия характеризуются высокой удельной прочностью, которая сравнима с прочностью высокопрочных сталей. Сплавы алюминия имеют низкую плотность, составляющую 2,5 – 2,8 г/см3. Они также имеют такие достоинства как удовлетворительную стойкость против атмосферной коррозии, простоту получения и обработки.
Электротехнические материалы: полупроводники, диэлектрики, проводники, сверхпроводники.
По электрическим свойствам материалы делятся на диэлектрики, полупроводники, проводники и сверхпроводники. Они отличаются друг от друга электрической проводимостью и её механизмом, характером зависимости электрического сопротивления от температуры.
Диэлектрики. Это вещества, которые не обладают хорошей электронной проводимостью и поэтому являются изоляторами. Диэлектрики имеют удельное электрическое сопротивление в интервале от 108 до 1016 Ом∙м. Некоторые из них также как и металлы имеют кристаллическую структуру. Вид химической связи в диэлектриках, в основном, ионный или ковалентный. Свободные носители заряда отсутствуют. Между валентной зоной и зоной проводимости находится широкая запрещенная зона. К диэлектрикам относятся полимерные материалы: соли, оксиды, полиэтилен, резина, текстильные материалы.
Диэлектрики, такие как керамика, стекло, пластмассы обладают высокой диэлектрической проницаемостью, значения которой находятся в пределах от 2 до 20. Но отдельные диэлектрики имеют значения относительной диэлектрической проницаемости около тысячи и выше. Такие диэлектрики называются сегнетоэлектриками.

Рис. 1. Схема расположения энергетических зон в металле (а), полупроводнике (б),
изоляторе (в).
Полупроводники. Полупроводники занимают промежуточное положение между изоляторами и проводниками, они отличаются как от металлов, так и от изоляторов. При низких температурах электрическое сопротивление полупроводников велико и они в этом отношении похожи на диэлектрики, хотя зависимость удельного электрического сопротивления от температуры у них отличается от таковой для изоляторов. При нагревании электрическая проводимость полупроводников растет, достигая величин, характерных для металлов.
Полупроводники имеют удельное электрическое сопротивление от 10-5 до 108 Ом∙м. К полупроводникам относятся B, C, Si, Ge, Sn, P, As, Sb, S, Se, Te, I. Полупроводниками являются такие бинарные соединения ZnO, FeO, ZnS, CdS, GaAs, ZnSb, SiC, а также более сложные соединения.
Ширина запрещенной зоны в полупроводниках изменяется от 0,08 эВ (у металла Sn) до 5,31 эВ (неметалла алмаз). Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. У них, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 1). Однако ширина запрещенной зоны в случае полупроводников существенно меньше, чем у диэлектриков. Благодаря этому при действии облучения или при нагревании, электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры и увеличением освещенности число электронов, переходящих в зону проводимости, возрастает, что приводит к росту электрической проводимости полупроводника.
В полупроводниках с ковалентной связью появление электрона в зоне проводимости одновременно создает его вакансию в валентной зоне. Данные вакансии называются дырками. Они могут участвовать в движении под действием электрического поля. Поэтому электрический ток в полупроводниках определяется движением электронов в зоне проводимости и движением дырок в валентной зоне. В первом случае электроны переходят на незанятые молекулярные орбитали, во втором – на частично занятые молекулярные орбитали.
Из простых полупроводников наиболее распространены кремний и германий. Полупроводники применяются в радиоэлектронных приборах.
Проводники. Это вещества, которые проводят электрический ток. К проводникам относятся металлы. Удельное электрическое сопротивление проводников изменяется от 10-8 до 10-5 Ом∙м. С повышением температуры электрическое сопротивление увеличивается, этим они и отличаются от полупроводников. Носителями заряда в проводниках являются электроны. Валентная зона и зона проводимости электронной структуры металлов пересекаются (рис. 1 а). Это позволяет электронам из валентной зоны переходить при небольшом возбуждении на молекулярные орбитали зоны проводимости.
Проводники применяются для передачи электрической энергии на большие расстояния, в качестве резисторов, нагревательных элементов, осветительных приборов.
Сверхпроводники. Материалы, у которых электрическое сопротивление при некоторой критической температуре резко уменьшается до нуля, называются сверхпроводниками. У обычных веществ падение электрического сопротивления практически до нуля возможно только при низких температурах. Например, у ртути она составляет 4,2 К. Поэтому широкое практическое использование сверхпроводимости нецелесообразно, так как связано с большими энергетическими затратами на охлаждение до очень низких температур.
В 1988 году было открыто явление высокотемпературной сверхпроводимости. Найдены такие вещества, которые проявляют сверхпроводящие свойства при достаточно высоких температурах порядка 90 – 135 К. Такие температуры могут быть достигнуты в среде жидкого азота. Это открывает возможности практического использования явления сверхпроводимости.
Высокотемпературные свойства обнаружены у следующих веществ: Y-Ba-Cu-O (Tc = 90 K), Bi - Ca – Cu – O (Tc = 110 K), Hg – Ba – Ca – Cu – O (Tc = 135 K).
В настоящее время ведутся поиски новых систем, которые могли бы находиться в сверхпроводящем состоянии при температурах кипения диоксида углерода, которая равна 194,7 К.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6431; Нарушение авторских прав?; Мы поможем в написании вашей работы!