
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическое перенапряжение
|
|
|
|
В 1930г. Эрдей Груз и М. Фольмер вывели уравнение, описывающее зависимость скорости реакции перехода от потенциала. Скорость гетерогенной химической реакции для простоты первого порядка, отнесенная к единице поверхности твердой фазы, описывается известным уравнением химической кинетики:
v = - = kCe-,
где v -скорость реакции, k - константа скорости реакции, С - концентрация реагирующего вещества на границе раздела фаз, Е - энергия активации процесса. Множитель e-E/RT показывает долю вещества от концентрации С, способную вступить в химическое взаимодействие (долю частиц, энергия которых равна и выше Е). Для электрохимического процесса
Ox + ze = Red
уравнение принимает вид
i+ = k`+[Red] e-;
i- = -k`-[Ox] e-,
где i+ и i- - анодный и катодный тoки, k'+_ и k`--константы скоростей катодной и анодной реакций, [Red] и [Ox] -активные концентрации восстановленной и окисленной формы вещества. Знак минус перед правой частью уравнения необходим, чтобы получить отрицательное значение катодного тока.
Характерно, что энергия активации стадии перехода зависит от величины потенциала. Уменьшение потенциала приводит к уменьшению Е- и к увеличению Е+, а увеличение - к увеличению Е-_и к уменьшению E+. С учетом зависимости Е- и Е+ от потенциала уравнение записывается следующим образом:
i+ = k+ [Red] e2,3j/ba;
i- = -k- [Ox] e-2,3j/bk,
где ba и bk - коэффициенты пропорциональности для анодной и катодной реакций.
Из уравнения Фольмера следует, что скорость электродной реакции находится в экспоненциальной зависимости от потенциала. При увеличении потенциала скорость анодной реакции возрастает, а катодной уменьшается.
При значительном смещении потенциала электрода от его равновесного значения ток обратной реакции по сравнению с током прямой реакции становится пренебрежительно малым и внешний ток становится равным прямому току:
ia = k+[Red]e2,3j/ba – k-[Ox]e-2,3j/bk = i+ = k+[Red]e2,3j/ba;
ik = i- = -k-[Ox]e-2,3j/bk.
На рисунке показана зависимость катодного и анодного токов от потенциала
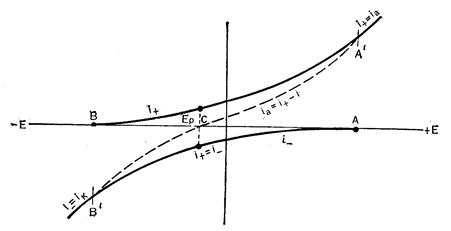
Точка С на оси потенциалов соответствует равновесному потенциалу, при котором i+ = ½i-½ и внешний ток равен нулю. При потенциале в точке В i+® 0
и ik = i-_, а при потенциале в точке A i- ® 0 и ia = i+. Пунктирная кривая, проходящая через точки В, С, А, является реальной поляризационной кривой, показывающей зависимость внешнего тока от потенциала, который равен алгебраической сумме токов i+. + i-.
Из уравнения Эрдей Груза и Фольмера можно получить зависимость перенапряжения перехода hп от плотности внешнего тока, когда iвн = ia или iвн =ik. Так как согласно уравнению hn=ji-jp,то из уравнений находят значение ji путем их логарифмирования, а также jр при i+ = ½i-½ = i0 из уравнений. После подстановки значений ji и jр перенапряжение катодной реакции при iвн = i-:
h- = bklgi0 - bk½lgik½.
Перенапряжение анодной реакции
h+ = -balgi0 + balgia.
Если bklgi0 и – balgi0 обозначить через константны ak и aa, то уравнения примут вид
h- = ak - bklg½ik½;
h+ = aa + balgia.
Зависимость перенапряжения от плотности тока была установлена опытным путем И. Тафелем и получила название уравнения Тафеля.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 968; Нарушение авторских прав?; Мы поможем в написании вашей работы!