
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Необратимые и обратимые реакции.
О химическом равновесии
Кинетические представления
ЛЕКЦИЯ 10
Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакцию считают необратимой, протекающей до конца.
К необратимым принято относить взаимодействия между веществами, в результате которых образуются осадки, газы и малодиссоциирующие вещества.
Множество химических реакций протекает обратимо. Их особенность состоит в том, что они не идут до конца, в системе всегда остается каждое из исходных веществ.
Реакцию, протекающую вправо, называют прямой, а влево - обратной. Если в системе скорость прямой реакции 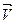 равна скорости обратной реакции
равна скорости обратной реакции  , состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство
, состояние системы называется химическим равновесием. Таким образом, кинетически условием химического равновесия является равенство
 . (35)
. (35)
Если равенство (35) является кинетическим условием равновесия, то равенство (DG)р,т=0 - термодинамическим условием химического равновесия. Если (DG)р,т =0, скорость прямой реакции 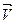 при данных р и Т равна скорости обратной реакции
при данных р и Т равна скорости обратной реакции  . Неравенству(DG)р,т <0 отвечает неравенство
. Неравенству(DG)р,т <0 отвечает неравенство  , при этом самопроизвольно идет прямая реакция и в системе накапливаются продукты реакции. Наоборот, когда (DG)р,т >0. скорость обратной реакции больше, чем прямой:
, при этом самопроизвольно идет прямая реакция и в системе накапливаются продукты реакции. Наоборот, когда (DG)р,т >0. скорость обратной реакции больше, чем прямой:  . Самопроизвольно при этом идет обратный процесс, и концентрация продуктов реакции в системе понижается.
. Самопроизвольно при этом идет обратный процесс, и концентрация продуктов реакции в системе понижается.
Химическое равновесие характеризуется постоянным и вполне определенным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции и обозначается КC.
Для обратимой реакции, протекающей в гомогенной системе (где все вещества жидкости или газы),

константа равновесия имеет вид
 . (36)
. (36)
Выражение (36) является записью закона действующих масс для обратимых реакций. Его можно вывести исходя из кинетических представлений:
 (37)
(37)
или
 .
.
С учетом (36) получим
 . (38)
. (38)

Время
Рис. 15
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов. Константа равновесия так же, как и константы скоростей k1 и k2, зависит от природы реагентов, температуры и не зависит от исход исходных концентраций в системе.
Концентрации газообразных веществ в выражении (36) могут быть сменены равновесными парциальными давлениями этих веществ:
 . (39)
. (39)
Если обратимая реакция протекает в гетерогенной системе, то константа равновесия Кр равна отношению равновесных парциальных давлений газообразных веществ и не зависит от абсолютного и относительного количеста веществ, находящихся в конденсированном виде.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 372; Нарушение авторских прав?; Мы поможем в написании вашей работы!