
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Ле Шателье
|
|
|
|
Химическое равновесие, отвечающее равенству скоростей прямой и обратной реакций  и минимальному значению энергии Гиббса (DG0т =O), является наиболее устойчивым состоянием системы при заданных условиях и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается влево или вправо. Через некоторое время система вновь становится равновесной, т.е. она переходит из одного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
и минимальному значению энергии Гиббса (DG0т =O), является наиболее устойчивым состоянием системы при заданных условиях и остается неизменным до тех пор, пока сохраняются постоянными параметры, при которых равновесие установилось. При изменении условий равновесие нарушается и смещается влево или вправо. Через некоторое время система вновь становится равновесной, т.е. она переходит из одного состояния в другое. Новое равновесие характеризуется новым равенством скоростей прямой и обратной реакций и новыми равновесными концентрациями всех веществ в системе.
Химическое равновесие является подвижным (динамическим). Оно смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций, тем самым нарушая равенство скоростей. Если при изменении внешних условий химическое равновесие нарушается так, что скорость прямой реакции
становится больше скорости обратной реакции  , то равновесие смещается вправо. Если же равновесие нарушается так, что скорость прямой реакции становится меньше, чем скорость обратной реакции
, то равновесие смещается вправо. Если же равновесие нарушается так, что скорость прямой реакции становится меньше, чем скорость обратной реакции 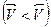 , то равновесие смещается влево. Направление смещения равновесия в общем случае определяется принципом Ле Шателье:
, то равновесие смещается влево. Направление смещения равновесия в общем случае определяется принципом Ле Шателье:
если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Смещение равновесия может быть вызвано изменением температуры, концентрации одного из реагентов, давления. Температура - тот параметр, от которого зависит величина константы равновесия химической реакции. При повышении температуры уменьшается константа равновесия экзотермического процесса DH0т <О или DU0т <0), при понижении температуры увеличивается. Это значит, что при повышении температуры равновесие экзотермической реакции смещается влево, поскольку прямая реакция идет с выделением теплоты.
Скорость как экзотермической, так и эндотермической реакции при повышении температуры растет, а при понижении уменьшается. Однако изменение скоростей 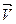 и
и  при повышении (или понижении) температуры не одинаково, поэтому варьируя температуру, можно смещать равновесие в заданном направлении.
при повышении (или понижении) температуры не одинаково, поэтому варьируя температуру, можно смещать равновесие в заданном направлении.
Смещение равновесия может быть вызвано изменением концентрации одного из компонентов: добавлением вещества в равновесную систему или выводом его из системы. По принципу Ле Шателье, при изменении концентрации одного из участников реакции равновесие смещается в сторону, компенсирующую изменение, т.е. при повышении концентрации одного из исходных веществ - вправо, а при повышении концентрации одного из продуктов реакции - влево.
Действительно, при увеличении концентрации исходного вещества А (или В) в равновесной системе А+В <=> C+D равенство скоростей 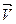 =
= нарушается, так как возрастает скорость прямой реакции
нарушается, так как возрастает скорость прямой реакции
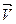 =к1СAСB; равновесие смещается вправо
=к1СAСB; равновесие смещается вправо . Если же увеличить концентрацию продукта реакции С (или D), то возрастет скорость обратной реакции
. Если же увеличить концентрацию продукта реакции С (или D), то возрастет скорость обратной реакции  = к1СCСD, равновесие смещается влево
= к1СCСD, равновесие смещается влево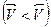 .
.
Если в обратимой реакции участвует хотя бы одно газообразное вещество, смещение равновесия может быть вызвано изменением давления. Повышение давления при T=const равносильно сжатию газа, т.е. увеличению его концентрации. При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом
действующих масс растет, что приводит к смещению равновесия в направлении уменьшения концентрации газообразного компонента. При понижении давления при T=const газ расширяется и его концентрация в системе падает. Это вызывает понижение скорости реакции; равновесие смещается в направлении увеличения давления газа.
Если в реакции участвуют несколько газообразных веществ, то при изменении давления одновременно и одинаково изменяются все их концентрации. Однако смещение равновесия может при этом не произойти.
Итак, в соответствии с принципом Ле Шателье при повышении давления равновесие смещается в сторону образования меньшего количества молей газообразных веществ в газообразной смеси и, соответственно, в сторону уменьшения давления в системе. Наоборот, при внешнем воздействии, вызывающем понижение давления, равновесие смещается в сторону образования большего количества молей газа, что и противодействует внешнему воздействию и вызывает увеличение давления в системе.
На основе принципа Ле Шателье можно подобрать такие условия осуществления химического равновесия, которые обеспечивают наибольший выход продуктов реакции. Принцип Ле Шателье справедлив не только для химических равновесий; он приложим и к процессам фазовых превращений: к испарению, конденсации и др.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 760; Нарушение авторских прав?; Мы поможем в написании вашей работы!