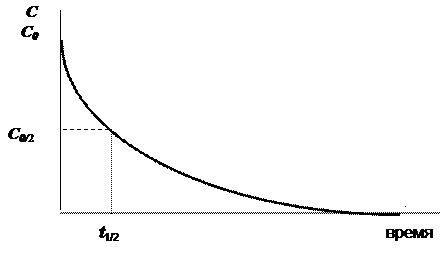КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции. Время полупревращения
|
|
|
|
Скорость реакции v - это её интенсивность, выраженная количественно. Она определяется числом молекул, реагирующих в единицу времени в единице объёма. Так как это число эквивалентно изменению количества какого-либо вещества (исходного или продукта), то можно записать:
| d n v = ±¾¾¾, V d t |
где V - реакционный объём; d n /d t - изменение количества вещества (моль) в единицу времени.
Или, принимая n / V = С,
| d С v = ± ¾¾, (12.1) d t |
где С - концентрация.
Различают истинную (мгновенную) скорость реакции, которая определяется как бесконечно малое изменение концентрации за бесконечно малое время, что математически выражается уравнением (12.1), и среднюю скорость, которая определяется как изменение концентрации за всё время протекания реакции или за какой-либо интересующий экспериментатора отрезок времени:
| DС С 2 - С 1 v ср = ± ¾¾ = ± ¾¾¾¾, (12.2) d t t 2 - t 1 |
где С 1 и С 2 - концентрации исследуемого вещества, наблюдаемые соответственно начальный и конечный в моменты времени t 1 и t 2.
Из уравнений (12.1 и 12.2) следует, что если скорость реакции определяется по одному из исходных веществ, разность С 2 - С 1 будет иметь отрицательный знак, а если по одному из продуктов - то положительный. Скорость реакции всегда положительна, поэтому при вычислении её по исходным веществам в уравнениях (12.1) и (12.2) оставляется знак минус, при вычислении по продуктам - знак плюс.
В общем случае следует различать скорость реакции в целом и скорость реакции по данному веществу. Например, рассмотрим реакцию синтеза аммиака
N2 + 3H2 Û 2NH3.
Совершенно очевидно, что убыль концентрации водорода в единицу времени втрое превышает убыль концентрации азота, а скорость образования аммиака вдвое больше скорости расходования N2 и в 1,5 раза меньше скорости расходования Н2. Следовательно, скорость реакции по азоту не равна скорости по водороду и скорости по аммиаку.
Размерность скорости химической реакции в соответствии с определением - [концентрация/время]. В системе СИ это моль/м3.·с, в обычной лабораторной практике используют также размерности моль/л·с или моль/л·мин.
В каждом конкретном случае размерность скорости реакции может быть выражена различными единицами в зависимости от самой скорости. Так, например, для реакций разложения лекарственных веществ или коррозии металлов в качестве единицы времени обычно выбирается год, а для реакций, идущих с очень большой скоростью, например, взрывов, реакций нейтрализации и т. п. - доли секунды (милли-, микросекунда и т. д.).
Общая скорость сложной реакции зависит от скорости самой медленной из её стадий (лимитирующая стадия).
Скорость химических реакций, за исключением реакций нулевого порядка, с течением времени не остаётся постоянной, а замедляется. Причём это замедление носит нелинейный характер, т. е. чем больше времени прошло с начала реакции, тем медленнее она протекает. Средняя скорость за всё время протекания реакции часто бывает очень трудно или даже невозможно определить экспериментально, что связано со сложностью фиксации момента, в который прореагирует последняя молекула одного из исходных веществ. Поэтому в качестве ещё одной кинетической характеристики реакций было введено понятие времени полупревращения t 1/2 (в случае реакций разложения называемого также временем полураспадаили периодом полураспада). Время полупревращения t 1/2 - это время, за которое прореагирует половина взятого для реакции исходного вещества. В отличие от средней скорости за полное время протекания время полупревращения определяется довольно просто и с высокой точностью, что можно проиллюстрировать рис. 12.1.
Рис. 12.1. Зависимость концентрации реагирующих веществ от времени. С0 - начальная концентрация исходного вещества, t 1/2 - время полупревращения |
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1227; Нарушение авторских прав?; Мы поможем в написании вашей работы!