
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакционная способность в водных средах
|
|
|
|
Реакционная способность взаимодействия металлов с водой.
Взаимодействие металлов с водными растворами имеет большое значение при оценке их химической устойчивости при эксплуатации.
Взаимодействие металлов с водными растворами происходит по электро-химическому механизму. Поэтому удобно пользоваться показателем не ∆G а потенциалом ∆E.
∆E = - (∆G/zF); z – кол-во ē протекающих в реакции, F – число Фарадея.
F = 96500 Кл
F = NA * qe
Часто ∆E можно измерить экспериментально, измерить ∆G экспериментально – сложно.
Есть таблицы где приведены потенциалы, по которым удобно посчитать ∆E.
∆E>0, ∆G<03
Проверим на примере:
Zn + 2 HCI = ZnCI2 + H2
Zn + 2H+ + 2CI- = Zn2+ + 2CI- +H2
Zn2+ +2 ē = Zn2+ +H2
Zn2+ +2 ē = Zn, E0 = -0,76B
2H+ + 2 ē = H2, E0 = 0,00B
- Zn2+ + 2H+ = - Zn + H2;
∆E = -(-0,76) + 0 = +0,76
∆E = Eокисл – Евосст > 0 – уравнение самопроизвольного протекания электрохимической реакции.
Рассмотрим как металлы реагируют с водой в зависимости от pH раствора.
рН = - Lg [H+]
в воде всегда присутствуют 2 окислителя:
1) H+ + 2 ē = H2 ; Зависимость потенциала этой реакции Е0Н/Н2 = -0,06 рН
2) О2 + 2Н2О + 4 ē = 4 ОН-; Е0О2/ОН = 1,23 – 0,06 рН
Рассмотрим растворы, нейтральный рН=7 и кислый рН=0
| рН Е,В | ||
| Е0Н/Н2 | -0,42 | |
| Е0О2/ОН | 1,23 | 0,81 |
Совместим значения потенциалов металлов с потенциалами окислителей (Н+ и О2) и вследствии этого все металлы разделяют на 5 групп:
1) Эти металлы взаимодействуют даже с нейтральными растворами при отсутствии О2. Группа абсолютно термодинамически неустойчивых металлов.
2) Эти металлы устойчивы в обескислороженной нейтральной воде. Но реагируют с кислотами.
3) Эти металлы устойчивы в обескислороженных кислотах, но взаимодействуют с кислородосодержащими нейтральными растворами (водами).
Cu2+ +2 ē = Cu, E0 = + 0.34B
Эти металлы называются полублагородными т.к. в кислоте почти не растворяются ЕАg ≈ 0,8 В.
4) Эти металлы устойчивы в обескислороженных кислотах. Они устойчивы в нейтральных кислородосодержащих растворах. Но взаимодействуют с растворами кислот содержащих О2
К этой группе относят платиноиды (6 шт.)
Pt,Pd…
E0 ≈ 1.1 B
5) Металлы устойчивы во всех средах даже кислотах содержащих растворенный О2
ЕAu = + 1.5 B
Металлы 4 и 5 групп называются благородными.
Примечание 1
Расмотренный ряд активности металлов говорит о термодинамической возможности протекания реакций, однако о скорости т.е. о кинетике протекания по нему судить нельзя. Поскольку скорость реакции определяется энергией активации.
(График)
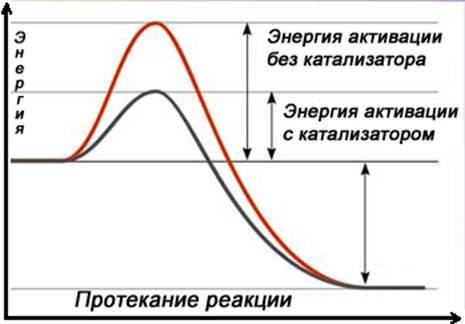
Например: потенциал АI (-1,66 В) отрицательнее потенциала Fe (-0,44 В), однако в нейтральных средах АI значительно более устойчив чем Fe. Но если мы поместим AI и Fe в щелочной раствор, то в нем скорость растворения AI значительно выше чем у Fe.
Примечание 2
В практической реальности редко встречается чистая вода, в растворе всегда содержится катионы, анионы, ПАВ, комплексообразующие агенты. При этом потенциал реакций а так же кинетика могут серьезно изменятся.
Например: Au0 + 4HCI + HNO3 = H[AuCI4] + NO + 2 H2O
[AuCI4]- + 3 ē = Au + 4 CI-
Au3+ + 3 ē = Au, E = 1.5 B
При промышленной добыче золота его используют при растворении водных растворов цианидов.
4Au0 + O2 + 8NaCN + 2H2O = 4 Na[Au(CN)-2]- + 4NaOH
Примечание 3
Потенциал реакции окисления или восстановления металла зависит от его концентрации, во многих случаях его трудно определить.
Например: Fe корродирует в растворе NaCI
Fe - 2 ē = Fe2+
4Fe2+ + O2 + 10 H2O = 4 Fe(OH)3 + 8H+
EFe = -0.44 + 0.03Lg[Fe2+]
В силу этих примечаний приведенный ряд активности металлов нужно использовать с осторожностью.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 721; Нарушение авторских прав?; Мы поможем в написании вашей работы!