
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Осмотическое давление
|
|
|
|
Осмос (от греч. osmos- толчок, давление)- диффузия вещества (обычно растворителя) через полупроницаемую перегородку (мембрану), разделяющую чистый растворитель и раствор или два раствора различной концентрации, и проницаемую только для растворителя.
Полупроницаемые мембраны представляют собой стенки тканей животных и растений, искусственные органические мембраны - желатин, целлофан, осадочные мембраны, например, Cu2[Fe(CN)6].
Сила (на единицу площади) π, заставляющая растворитель переходить через полупроницаемую мембрану в раствор, находящийся при том же внешнем давлении, что и растворитель, называется осмотическим давлением.
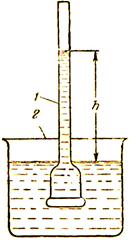 На рис. 2 показан простейший прибор для измерения осмотического давления. В сосуде 1, закрытом снизу полупроницаемой мембраной, находится водный раствор какого-нибудь вещества. В сосуд 2 залита вода. В результате осмоса растворитель из сосуда 2 поступает в сосуд 1.
На рис. 2 показан простейший прибор для измерения осмотического давления. В сосуде 1, закрытом снизу полупроницаемой мембраной, находится водный раствор какого-нибудь вещества. В сосуд 2 залита вода. В результате осмоса растворитель из сосуда 2 поступает в сосуд 1.
Рис. 2. Простейший прибор для измерения осмотического
давления: 1- внутренний сосуд; 2 - внешний сосуд
Уровень раствора в сосуде 1 повышается. При этом создаётся дополнительное давление, которое препятствует осмосу. При некоторой высоте h столба жидкости это гидростатическое давление равно осмотическому давлению, и осмос прекращается. Т.е. устанавливается равновесие между раствором данной концентрации и чистым растворителем. Знак гидростатического давления противоположен знаку осмотического давления. Увеличивая извне давление в сосуде 1, можно заставить воду переходить из сосуда 1 в сосуд 2. При этом концентрация раствора в сосуде 1 будет возрастать до тех пор, пока не достигнет значения, соответствующего увеличенному давлению. Поэтому осмотическое давление можно определить, как дополнительное давление, которое необходимо приложить к раствору, чтобы предотвратить поступление в него (или удаление из него) растворителя через полупроницаемую мембрану.
Значение p зависит от состава растворов, разделённых мембраной, и температуры.Для разбавленных растворов справедливо уравнение Вант Гоффа для осмотического давления (1887):
p=cRT, (22)
где с - молярная концентрация раствора.
Сходство уравнения (22) с уравнением Клапейрона-Менделеева чисто формальное, так как осмотическое давление не связано с ударами частиц о стенки мембраны. Оно обусловлено различием значений химического потенциала растворителя по обе стороны полупроницаемой перегородки. Выведем уравнение (22). Пусть осмос протекает равновесно, т.е. разность между осмотическим и внешним давлением будем считать бесконечно малой. В этом случае осмотическое давление совершает работу
dA=pdV=p V dn1, (23)
где V - парциальный молярный объём растворителя, dn1- количество вещества растворителя, перешедшее в более концентрированный раствор в результате осмоса. В результате осмоса изменение энергии Гиббса
dG=(m1-m°)dn1=(RTlnN1)dn1=RTln(1-N2)dn1»-RTN2dn1, (24)
где m°, m1 - химические потенциалы растворителя чистого и в растворе.
Поскольку для равновесного процесса -DG=dA, то из (23,24) следует
p=(N2/ V)RT (25)
Поскольку V»V/n1, где V - объём раствора, а для разбавленных растворов N2»n2/n1, то из (25) получаем (22).
Измеряя осмотическое давление раствора, содержащего определённую массу вещества, можно определить молекулярную массу этого вещества.
Осмос играет огромную роль в растительных и животных организмах, способствуя оводнению клеток и межклеточных структур. Если растительная клетка помещена в концентрированный раствор соли или сахара, то наблюдается осмотическое всасывание воды из клетки во внешний раствор – экзоосмос. При этом протоплазма начинает отставать от стенок целлюлозной оболочки (сморщиваться) и уменьшается в объёме (плазмолиз). Плазмолиз - обратимый процесс. Если концентрация соли, сахара в клетке больше, чем во внешнем растворе, то происходит осмотическое всасывание воды в клетку из внешнего раствора – эндоосмос. Состояние осмотического напряжения клетки, обусловленное повышенным осмотическим давлением, называется тургор (от позднелат. turgor - вздутие, наполнение). Тургор поддерживает листья и стебли, придавая растениям прочность и устойчивость. Увядание растения связано с уменьшением тургора. Осмос свойственен и животным тканям и клеткам. Эритроциты уменьшаются в объёме в результате экзоосмоса. В результате эндоосмоса наблюдается увеличение объёма эритроцитов, они разрываются, во внешнюю среду выделяется гемоглобин, и раствор окрашивается в красный цвет (гемолиз). Раствор с осмотическим давлением, равным осмотическому давлению клеток и тканей называется изоосмотическим или изотоническим. Такие растворы называют ещё физиологическими. Раствор с большим осмотическим давлением, чем внутри клетки называется гипертоническим, а с меньшим – гипотонический. Осмотическое давление в растениях изменяется от 5 до 20 атм. В растениях пустынь и засолённых почв - 50-100 атм. Корни всегда имеют более низкое осмотическое давление, чем наземные части растения, например, листья. У морских рыб осмотическое давление равно осмотическому давлению морской воды за счёт выделения мочевины, образующейся в результате распада белковых веществ. Осмотическое давление в крови человека при нормальной температуре 7,7-8,1 атм.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!