
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атом водню по Бору
|
|
|
|
 Теорія атома Бора - перша квантова теорія водневого атома (або одноелектронного іона) на основі планетарної моделі Резерфорда. Розробив її Н. Бор у 1913 році. Ґрунтувалася вона на постулатах, які носять його ім’я. Розглянемо цю теорію.
Теорія атома Бора - перша квантова теорія водневого атома (або одноелектронного іона) на основі планетарної моделі Резерфорда. Розробив її Н. Бор у 1913 році. Ґрунтувалася вона на постулатах, які носять його ім’я. Розглянемо цю теорію.
Припускаючи, що між електроном і ядром діє сила кулонівського притягання, для доцентрової сили маємо
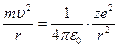 , (9.9)
, (9.9)
де zе – заряд ядра; е – заряд електрона; e0 – електрична стала. Із (9.8) та (9.9) знаходимо: швидкість електрона на стаціонарній орбіті
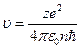 , (9.10)
, (9.10)
радіус цієї орбіти визначається за такою формулою
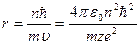 (9.11)
(9.11)
(для незбудженого водневого атома радіус першої від ядра орбіти становить близько 50 пм), та значення енергії для певного стаціонарного стану
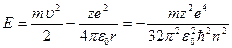 . (9.12)
. (9.12)
3 (9.12) видно, що Е набуває дискретних значень відповідно до значень головного квантового числа 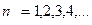 Найменша енергія, яку має електрон у найближчому (нормальному, незбудженому) стані при
Найменша енергія, яку має електрон у найближчому (нормальному, незбудженому) стані при 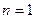 , становить
, становить
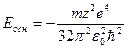 (9.13)
(9.13)
i для водню (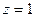 ) дорівнює -13.6 eB. Таку енергію потрібно витратити, щоб іонізувати атом водню. Користуючись другим постулатом Бора можна визначити частоту світла, яка випромінюється атомом при переході з вищого рівня (
) дорівнює -13.6 eB. Таку енергію потрібно витратити, щоб іонізувати атом водню. Користуючись другим постулатом Бора можна визначити частоту світла, яка випромінюється атомом при переході з вищого рівня (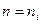 ) на нижчий (
) на нижчий (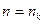 )
)
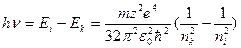 .
.
Звідси
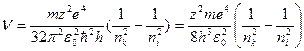 . (9.14)
. (9.14)
Припускаючи, що 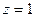 (водень) і позначивши
(водень) і позначивши 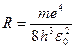 дістаємо відому формулу (9.2). Виведена Бором формула пояснила походження спектральних серій у спектрі водню.
дістаємо відому формулу (9.2). Виведена Бором формула пояснила походження спектральних серій у спектрі водню.
Згідно теорії Бора, спектральні серії відповідають випромінюванню, що виникає в результаті переходу атома в цей стан зі збудженого стану, який міститься вище даного.
Спектр поглинання атому водню лінійчатий, але містить тільки серію Лаймана. Це так само пояснюється теорією Бора. Вільні атоми водню, звичайно, знаходяться в основному стані з найменшою енергією. Тобто при наданні атомам ззовні певної енергії, можна спостерігати лише переходи атомів з основного стану в збуджений (виникає тільки серія Лаймана).
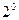 Разом з тріумфом теорія Бора мала ряд недоліків: не могла розшифрувати спектри багатоелектронних атомів, наприклад атома гелію, пояснити відмінність в інтенсивності та поляризації спектральних ліній тощо. Найголовніший недолік – це внутрішні суперечності в самій теорії, а саме: Бор, користуючись квантовими постулатами, розглядає рух електрона в атомі з класичного погляду. У 1916 році Зомерфельд поглибив теорію Бора, врахувавши еліптичні орбіти електронів. Послідовну теорію атома було створено на основі хвильових властивостей мікрочастинок.
Разом з тріумфом теорія Бора мала ряд недоліків: не могла розшифрувати спектри багатоелектронних атомів, наприклад атома гелію, пояснити відмінність в інтенсивності та поляризації спектральних ліній тощо. Найголовніший недолік – це внутрішні суперечності в самій теорії, а саме: Бор, користуючись квантовими постулатами, розглядає рух електрона в атомі з класичного погляду. У 1916 році Зомерфельд поглибив теорію Бора, врахувавши еліптичні орбіти електронів. Послідовну теорію атома було створено на основі хвильових властивостей мікрочастинок.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1007; Нарушение авторских прав?; Мы поможем в написании вашей работы!