
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация субстрата
|
|
|
|
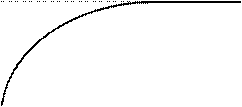
Для ферментативных реакций характерно явление насыщения фермента субстратом. Заключается оно в том, что при увеличении концентрации S скорость сначала увеличивается, достигает максимального значения при некоторой концентрации субстрата а и остается постоянной. Происходит это потому, что при концентрации а весь фермент связан в фермент-субстратный комплекс.
Зависимость скорости ферментативной реакции от концентрации субстрата может быть описана уравнением:
υ = υmax/(1+ Kм/[S]),
где: Км – константа Михаэлиса, которая соответствует концентрации субстрата, при которой скорость реакции равна 1/2 υmax.
υ
 |
υmax
 |

 1/2 υmax
1/2 υmax
 |
Км [S]
 3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
υ

 t опт.
t опт.
 20 40 60 80
20 40 60 80
tº, С
В интервале температур от 0 до 45-50ºС зависимость скорости реакции подчиняется правилу Вант-Гоффа (при увеличении температуры на каждые 10ºС скорость реакции увеличивается в 2-4 раза). При температуре выше 50ºС фермент начинает денатурировать, и скорость реакции снижается. При температуре выше 80ºС фермент теряет активность и при 100ºС полностью инактивируется. При температур около 0ºС фермент обычно не разрушается, но активность их падает до нуля.
Температура при которой фермент наиболее активен, называют оптимумом действия фермента. Температурный оптимум действия большинства ферментов теплокровных животных – 37-40ºС, растительных ферментов – 50-60ºС.
4. рН среды
Влияние изменения рН среды на молекулу фермента заключается в ионизации кислотных и основных групп активного центра, что сказывается на электростатическом соответствии между ферментом и субстратом и их способностью формировать фермент-субстратный комплекс. Значение рН при котором фермент имеет наибольшую активность называют рН оптимумом действия фермента. Для некоторых ферментов он резко выражен, для других граница рН более широкая. рН оптимум действия большинства ферментов лежит в области физиологических значений (6,0-8,0).
 υ
υ
 |
рНопт рН
5. Активирование ферментов
Активаторы – увеличивают скорость ферментативных реакций.
Активаторами могут быть вещества различной химической природы. Например, пепсин активируется НС1 панкреатическая липаза – желчными кислотами, амилаза слюны – NaCl1/
Наиболее часто активаторами ферментов являются ионы двухвалентных и иногда одновалентных металлов.
Механизм активирующего действия может быть различным:
1. способствует присоединению субстрата к активному центру фермента и образованию ES-комплекса;
2. обеспечивают присоединение кофермента к апоферменту;
3. аллостерические активаторы – способствуют образованию более выгодной пространственной конфигурации активного центра;
4. активация частичным протеолизом и др.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 687; Нарушение авторских прав?; Мы поможем в написании вашей работы!