
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изоферменты
|
|
|
|
Компартментализация (отделение, отсек) в клетке
Регуляция путем изменения биосинтеза ферментов
Неконкурентное ингибирование
Неконкурентное ингибирование наблюдается, когда ингибитор и фермент не сходны по структуре и ингибитор присоединяется к регуляторному центру фермента. При этом образуется тройной комплекс: фермент-ингибитор-субстрат, который не приводит к образованию продуктов реакции. В данном типе ингибирования влияние ингибитора не может быть преодолено повышением концентрации субстрата.
Рассмотренные ранее способы изменения скорости протекания реакций направлены на изменение активности уже имеющихся ферментов. Существует другой способ регуляции — изменение содержания ферментов. В организме имеются вещества, которые, присоединяясь к белку — регулятору оперона, могут изменять скорость биосинтеза белков-ферментов: наблюдается либо усиление биосинтеза ферментов (индукция генов), либо замедление (репрессия генов).
Этот способ регуляции характерен только для высших форм живых организмов и позволяет осуществить наиболее тонкую регуляцию метаболизма. Он направлен на снижение скорости процесса за счет разъединения субстрата с ферментами с помощью мембраны. Перенос групп атомов и субстратов осуществляется за счет челночных механизмов, переводящих субстрат в форму, которая способна проникать через мембрану. Затем по другую сторону мембраны происходит обратное их превращение в первоначальную форму.
Изоферменты — это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по АК-составу, порядку связывания АК, электрофоретической подвижности, Км, локализации в клетке и органе. Изоферменты выполняют одинаковые биологические функции, но с различной эффективностью.
Например, лактатдегидрогеназа (ЛДГ) — олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н (сердце) и М (мышцы). ЛДГ существует в 5 формах, легко различающихся с помощью электрофореза. Пять изоферментов ЛДГ имеют следующий полипептидный состав: ЛДГ1 — (Н4); ЛДГ2 — (Н3М); ЛДГ3 —(Н2М2); ЛДГ4 — (НМ3); ЛДГ5 — (М4). Различные ткани человека имеют свои характерные изоферментные спектры. В сердечной мышце и почках наиболее высокой активностью обладают изоферменты ЛДГ1 и ЛДГ2. В печени и скелетной мускулатуре максимальны ЛДГ5. В селезенке, поджелудочной железе, щитовидной железе, надпочечниках - ЛДГ3.
Лактатдегидрогеназа катализирует обратимое восстановление пировиноградной кислоты (ПВК) в молочную (лактат), в котором в роли восстановителя выступает НАДН + Н+.
пируват + НАДН + Н+ «лактат + НАД+.
В тканях, в которых преобладает аэробный распад глюкозы, присутствуют обычно ЛДГ1 и ЛДГ2, для которых характерно низкое сродство к пирувату, и поэтому они не могут эффективно конкурировать за пировиноградную кислоту с пируватдегидрогеназным комплексом. В результате пировиноградная кислота подвергается преимущественно окислительному декарбоксилированию и образующийся в этой реакции ацетил-КоА «сгорает» в цикле трикарбоновых кислот. В тканях, где доминирует анаэробный гликолиз, присутствуют изоферменты с высоким сродством к пирувату: ЛДГ4 и ЛДГ5. В этих тканях пируват расходуется преимущественно в лактатдегидрогеназной реакции.
Механизм биохимической ферментативной реакции можно представить упрощенно в общем виде:

 E + S
E + S  ES
ES 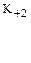 P + E.............................
P + E............................. 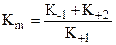
где Е — фермент;
S — субстрат;
ES — фермент-субстратный комплекс;
Р — продукты реакции;
К+1, К-1, К+2 — константы скоростей прямых и обратной реакций.
Константа Михаэлиса—Ментен (Km) характеризует константу диссоциации фермент-субстратного комплекса и численно равна концентрации субстрата (в моль/л), при которой скорость данной реакции составляет 1/2 от максимальной. Она характерна для каждой пары фермент-субстратного комплекса.
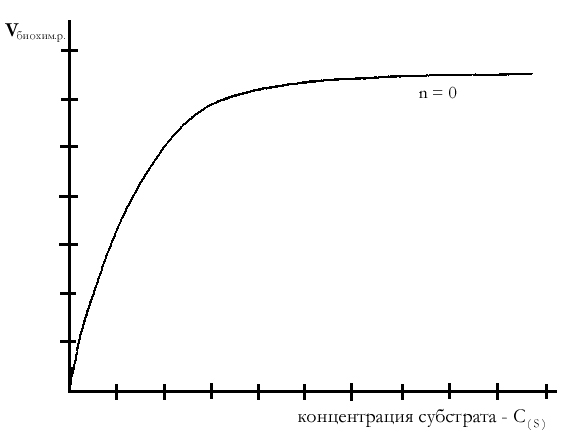
Уравнение Михаэлиса—Ментен выражает зависимость скорости биохимической ферментативной реакции от концентрации субстрата:

где Vбиохим.р.— скорость данной биохимической реакции,
Vmax — максимальная скорость биохимической реакции,
S — субстрат,
Кm — константа Михаэлиса—Ментен.
Анализ уравнения Михаэлиса—Ментен:
1) Если концентрация субстрата в реакции низка, т.е. [S] << Кm, то уравнение приобретает вид:
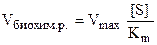
Таким образом, при низких концентрациях субстрата скорость биохимической реакции прямо пропорциональна концентрации субстрата и описывается уравнением I порядка.
2) При высоких концентрациях субстрата, т. е. [S] >> Кm, величиной Кm можно пренебречь, тогда
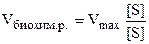 ,
, 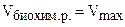
Таким образом, при высоких концентрациях субстрата скорость биохимической реакции становится максимальной и описывается уравнением нулевого порядка.
График зависимости скорости биохимической ферментативной реакции от концентрации субстрата
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 790; Нарушение авторских прав?; Мы поможем в написании вашей работы!