
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение активности фермента
|
|
|
|
Определить количественное содержание фермента в биологических объектах очень трудно, т.к. он присутствует в тканях в ничтожно малых концентрациях. Поэтому о количестве фермента судят по скорости катализируемой им реакции в стандартных условиях (t=25ºС, рН оптимальная, при полном насыщении фермента субстратом), и выражают в условных единицах.
За единицу активности фермента (Е- рус./нем. или U- англ./исп.) принимают такое количество фермента, которое в стандартных условиях катализирует превращение 1 мкмоль субстрата в минуту (1 мкмоль/мин). Это стандартная международная единица выражения количества фермента и его активности введена в 1962 г. Международным биохимическим союзом.
В международной системе единиц Си (1972 г.) предложена, вместо старой безымянной единицы ферментативной активности (Е или U), новая единица ферментативной активности – катал. 1 катал – это количество фермента, обеспечивающее превращение 1 моля субстрата в 1 секунду в стандартных условиях. Т.к. реакции идут гораздо с меньшей скоростью, то активность выражают в микро-, нано- и пикокаталах. 1Е = 16,67 нкат.
Для характеристики активности ферментов на практике часто используют следующие понятия:
1. Удельная активность – это число единиц ферментативной активности в 1 мг фермента, т.е. число мкмолей субстрата, превращаемое в 1 мин 1 мг фермента. Уд. активность выражается также числом каталов на 1 кг фермента (кат/кг);
2. Молярная активность – выражается в каталах на 1 моль фермента;
3. Молекулярная активность – это число молекул субстрата, превращенное в 1 мин 1 молекулой фермента. Например, молекулярная активность каталазы = 5 мин;
4. Концентрация фермента – выражается в единицах ферментативной активности Е на 1 мл раствора.
Классификация ферментов
Современная классификация ферментов разработана в 1961 г. Комиссией по ферментам Международного биохимического союза. В основу классификации положен тип катализируемой реакции, которая является специфичным для каждого фермента.
Согласно этой классификации все ферменты делят на 6 главных классов:
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции;
2. Трансферазы – катализируют реакции межмолекулярного переноса групп атомов и радикалов;
3. гидролазы– катализируют реакции расщепления при участии воды;
4. лиазы – катализируют реакции внутримолекулярного негидролитического расщепления, с образованием двойной связи или присоединения по двойной связи;
5. изомеразы – катализируют реакции изомеризации;
6. лигазы (синтетазы) – катализируют реакции синтеза с затратой энергии.
1. Оксидоредуктазы – делятся на подклассы в зависимости от типа реакции окисления:
а). Дегидрогеназы – отнимают от субстрата 2 атома водорода в виде двух протонов и двух электронов. Делятся на аэробные и анаэробные дегидрогеназы.
- 
 аэробные дегидрогеназы (оксидазы) передают отнятый водород на кислород с образованием воды или перекиси водорода:
аэробные дегидрогеназы (оксидазы) передают отнятый водород на кислород с образованием воды или перекиси водорода:
 H
H

 S + 1/2O2 S + H2O
S + 1/2O2 S + H2O
H







 CH2OH CH2OH
CH2OH CH2OH



|





|
|
 ОH O2 H2O2 H
ОH O2 H2O2 H
 | |||||
| 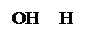 | ||||
OH H OH
H OH H OH
Глюкоза глюколактон
- анаэробные дегидрогеназы (редуктазы) катализируют перенос атомарного водорода на промежуточный субстрат. В общем виде:

 H H
H H


 S + S1 S + S1
S + S1 S + S1
H H
Все оксидоредуктазы – сложные ферменты. Непосредственными переносчиками водорода от субстрата являются коферменты дегидрогеназ. Большинство дегидрогеназ в качестве коферментов содержат НАД, НАДФ.


 НАД НАДН2
НАД НАДН2
|
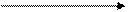


 СН3 – СН - СООН СН3 – СН - СООН
СН3 – СН - СООН СН3 – СН - СООН
ОН О
Молочная кислота ПВК (пировиноградная кислота)
в). оксигеназы – катализируют реакции, в ходе которых кислород включается в состав окисляемого субстрата.
Делятся на моно- и диоксигеназы:
- монооксигеназы (гидроксилазы) – включают в состав субстрата один атом молекулы кислорода, а второй восстанавливается до Н2О. Донором Н2 обычно является НАДФН2.
 НАДФН2 НАДФ
НАДФН2 НАДФ
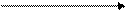 S - H + O2 S –OH + H2O
S - H + O2 S –OH + H2O
- диоксигеназы – присоединяют к субстрату оба атома O2
 S + O2 SO2
S + O2 SO2
г). пероксидаза и каталаза – гемсодержащие ферменты. Катализирующие реакции с участием Н2O2.
Простетическая группа имеет одно и тоже строение, содержит трехвалентное железо.
Пероксидаза окисляет органические соединения в организме с помощью O2 или разлагает ее с выделением активного кислорода:
 H
H

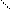 S + Н2O2 S + 2 H2O
S + Н2O2 S + 2 H2O
H
 Н2O2 H2O + O
Н2O2 H2O + O
Каталаза разлагает Н2O2 на H2O и молекулярный кислород:
 2 Н2O2 2 H2O + O2
2 Н2O2 2 H2O + O2
д). цитохромы – система ферментов, катализирующих перенос электронов на молекулярный кислород:
 O2 + 4e 2О2-
O2 + 4e 2О2-
Цитохромы являются гемопротеинами и завершают все окислительные процессы в клетках.
2. Трансферазы
Делятся на подклассы в зависимости от характера переносимых группировок:
а). метилтрансферазы – переносят метильную группу:
 R-CH3 + R1-H R-H + R1- CH3
R-CH3 + R1-H R-H + R1- CH3
б). аминотрансферазы (трансаминазы) – переносят аминогруппу в реакциях переаминирования с кетокислотами:


 R1 R2 R2
R1 R2 R2


 СН-NH2 + C=O R1 - CO-COOH + CH-NH2
СН-NH2 + C=O R1 - CO-COOH + CH-NH2
COOH COOH COOH
в). фосфотрансферазы – переносят остаток фосфорной кислоты:

 OH OH
OH OH


 R – P=O + R1 -H R- H + R1 -P=O
R – P=O + R1 -H R- H + R1 -P=O
OH OH
Если донором фосфорного остатка является АТФ, то фосфотрансферазы еще называют киназами!!!
|

|

 CH2OH CH2O-РО3Н2
CH2OH CH2O-РО3Н2
 |  | ||||||
 | |||||||
 | |||||||




 ОН ОН ОН ОН
ОН ОН ОН ОН
Н ОН Н ОН
глюкоза глюкозо-6-фосфат
 г). гликозилтрансферазы – переносят остаток моносахарида - гликозил;
г). гликозилтрансферазы – переносят остаток моносахарида - гликозил;
д). ацилтрансферазы – переносят кислотный остаток R-C=O и др.
3. Гидролазы
Делятся на подклассы в зависимости от характера субстрата. Основными из них являются:
а). эстеразы - ускоряют гидролиз сложных эфиров спиртов с органическими и неорганическими кислотами.
Важнейшие подподклассы эстераз:
- гидролазы эфиров карбоновых кислот (представитель – липаза).
Липаза ускоряет гидролиз внешних сложноэфирных связей в молекуле триглицеридов

 СН2-О-СО-R СН2-ОH
СН2-О-СО-R СН2-ОH



 CH –O-CO-R + 2H2O CH – O-CO – R + 2R-COOH
CH –O-CO-R + 2H2O CH – O-CO – R + 2R-COOH
СН2-О-СО-R СН2-ОH
- фосфатазы – гидролизуют фосфорные эфиры. Например, глюкозо-6-фосфатаза:




 CH2O- РО3Н2 CH2OH
CH2O- РО3Н2 CH2OH
|
|





 + 2H2O + Н3РО4
+ 2H2O + Н3РО4
ОН ОН ОН ОН
ОН ОН
Глюкозо-6-фосфат глюкоза
б). гликозидазы – расщепляют гликозидные связи в молекулах углеводов. Представители: сахараза, мальтаза,амилаза и др.
 CH2OH CH2OH CH2OH
CH2OH CH2OH CH2OH
 |  | ||||||
 | |||||||
 | |||||||
|







 ОН ОН ОН ОН
ОН ОН ОН ОН
ОН ОН ОН
Мальтоза глюкоза
в). пептидгидролаза – ускоряют гидролиз пептидных связей в белках и пептидах. Пептидгидролазы делятся на подподклассы:
1. Протеиназы или пептидил-пептидгидролазы или эндопептидазы. Они расщепляют пептидные связи внутри белковой молекулы, разлагая ее до пептидов. К ним относятся пепсин, трипсин, химитрипсин и др. ферменты. Их важная особенность – селективный характер действия. Они гидролизуют пептидные связи, образованные только определенными аминокислотами.
2. Пептидазы или экзопептидазы, отщепляющие концевые аминокислоты. К ним относятся:
- аминопептидазы (отщепляют N-концевые аминокислоты);
- карбоксипептидазы (отцепляют С - концевые аминокислоты).
г). амидазы – гидролизуют амиды кислот. Представители: уреаза, аспарагиназа и др.
 NH2-CO - NH2 + H2O 2 NH3 + CO2
NH2-CO - NH2 + H2O 2 NH3 + CO2
Мочевина уреаза
4. Лиазы
Систематические названия ферментов этого класса образуют из названия субстрата,затем указывают отщепляемую группу и затем добавляют слово лиаза. Делятся на подклассы в зависимости от действия на связи:
а). С – С – лигазы. К ним относятся ферменты декарбоксилазы.
Например:

 CН3
CН3


 СО CН3 – С=О + CO2
СО CН3 – С=О + CO2
СООН пируват- Н
ПВК декарбоксилаза
б). С-О- лигазы (гидролиазы). К ним относятся гидратазы
+ Н2О

 СООН-СН=СН-СООН ОН-СН-СООН
СООН-СН=СН-СООН ОН-СН-СООН
 фумаровая к-та - Н2О СН2 – СООН (яблочная к-та)
фумаровая к-та - Н2О СН2 – СООН (яблочная к-та)
фумаратгидратаза
в). С-N-лиазы и др. Например, аспартат-аммиак-лиаза, катализирующая расщепление аспартата до фумарата и аммиака.
5. Изомеразы
Систематическое название ферментов этого класса образуют по схеме: субстрат-тит реакции изомеризации-изомераза. При внутримолекулярном переносе групп ферменты имеют тривиальные названия мутызы.Катализируют различные реакции изомеризации (90 ферментов). Например превращение глюкозы-6-фосфат во фруктозу –6-фосфат.
CH2O- РО3Н2 CH2O- РО3Н2
 | |||||||
 | |||||||
| |||||||
|






 ОН
ОН
 | |||||
 |  |

 ОН ОН глюкозофосфат- ОН CH2OН
ОН ОН глюкозофосфат- ОН CH2OН
 ОН изомераза
ОН изомераза
ОН
α-глюкоза-6-фосфат β-фруктоза-6-фосфат
CH2O- РО3Н2 CH2OН
 | |||||
 | |||||
 | |||||

 ОН ОН фосфоглюкомутаза
ОН ОН фосфоглюкомутаза

 ОН O- РО3Н2
ОН O- РО3Н2
ОН ОН
Глюкоза-6-фосфат глюкоза-1-фосфат
Мутаротаза осуществляет взаимные превращения α- и β- изомеров.
6. Лигазы (синтетазы)
Систематическое название образуется по схеме: А: В лигаза (образующая АДФ), где А и В – соединяющиеся молекулы, в скобках указывается продукт расщепления нуклеозидтрифосфата, который использовался в данной реакции. Делятся на подклассы, ускоряющие реакции синтеза различных связей.
а). С-С-лигазы. Представителями лиаз, образующих С-С-связи, являются карбоксилазы, вызывающие удлинение углеродных цепей.
Например, пируваткарбоксилаза:

 CН3 СООН
CН3 СООН


 СО + CO2 + АТФ СН2 + АДФ + Фн
СО + CO2 + АТФ СН2 + АДФ + Фн
 СООН С= О
СООН С= О
СООН
ПВК оксилоацетат
б). С-О-лигазы. Такой тип связи возникает при действии аминоацил-тРНК-синтетаз, активирующих аминокислоты и передающих их на т-РНК:
АТФ АМФ + ФФн

 R-CH-COOH + тРНК R-CH-CO~тРНК
R-CH-COOH + тРНК R-CH-CO~тРНК

 NH2 NH2
NH2 NH2
в). С-N-лиазы. Эти ферменты участвуют, например, в синтезе различных амидов. К ним относится аспарагинсинтетаза.
 NH2
NH2

 СООН С=О
СООН С=О


 CH2 NH3 АТФ АДФ + Фн CH2
CH2 NH3 АТФ АДФ + Фн CH2


 СН-NH2 СН-NH2
СН-NH2 СН-NH2
COOH COOH
Асп. Асн.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 668; Нарушение авторских прав?; Мы поможем в написании вашей работы!