
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние концентрации реагирующих веществ. Закон действующих масс
|
|
|
|
Влияние природы реагирующих веществ
Влияние различных факторов на скорость химической реакции
На скорость химической реакции оказывает влияние различные факторы, к важнейшим из которых относятся:
- природа реагирующих веществ;
- концентрация реагирующих веществ;
- давление (для реакций, идущих с участием газов);
-площадь реакционной поверхности (для гетерогенных реакций);
- температура;
- внешнее воздействие на систему (световое или ионизирующее излучение; механическое воздействие; ультразвук и т.д.);
- присутствие катализатора или ингибитора.
Поскольку химическая реакция происходит только при столкновении частиц реагентов, определяющую роль играет их строение и характер химических связей, а также свойства образующихся веществ. Поэтому реакционная способность, а соответственно и скорость химической реакции даже в ряду однотипных соединений сильно отличается. Примером может служить взаимодействие между водородом и галогенами (элементами VII группы – фтором, хлором, бромом, йодом, астатом). Если реакция между фтором и водородом протекает необратимо при температурах близких к абсолютному нолю даже в темноте, то для взаимодействия йода и водорода требуется не только высокая температура, но и наличие катализатора. Причем даже в этих условиях реакция протекает обратимо. Самый же тяжелый из галогенов, астат, с водородом вообще не взаимодействует, и соответствующий ему галогеноводород можно получить только косвенным методом из водных растворов.
С увеличением концентрации реагентов (числа частиц в единице объема или на единице площади поверхности) чаще происходят столкновения молекул реагирующих веществ, и, по этой причине, скорость реакции возрастает.
В химической кинетике принято различать простые и сложные реакции. Простыми (элементарными) реакциями называются реакции, протекающие в одну стадию. Сложными реакциями называются процессы, имеющие сложный механизм и протекающие в несколько стадий, т.е. состоящие из некоторой последовательности элементарных реакций.
Зависимость скорости реакции от концентрации реагирующих веществ для элементарных реакций определяется по основному закону химической кинетики – закону действующих масс, открытому норвежскими учеными Като Гульдбергом и Петером Вааге в 1867 году. Закон формулируется следующим образом:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции.
Таким образом, для некоторой реакции, записанной в общем виде:
| аА + bВ = cC + dD, | (3) |
в соответствии с законом действующих масс скорость выражается соотношением:
| v = k×[A]a×[B]b, | (4) |
где [A] и [B] - молярные концентрации реагирующих веществ А и В соответственно; a и b - стехиометрические коэффициенты в уравнении реакции; k - константа скорости реакции.
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
Константа скорости реакции k численно равна скорости реакции при условии, что произведение концентраций всех реагирующих веществ или каждая в отдельности концентрация равны 1 моль/л (т.е. k = v, если [A]a = 1 и [B]b = 1). Такой физический смысл константы скорости указывает на то, что ее величина должна зависеть от всех тех факторов, которые влияют на скорость реакции, за исключением изменения концентрации реагирующих веществ. Поэтому константа скорости в отличие от скорости реакции не зависит от концентрации реагирующих веществ! Численное значение константы скорости реакции зависит от выбора единиц времени и концентрации. Константа скорости - величина, имеющая размерность, которая определяется кинетическим уравнением химической реакции.
Для гетерогенных реакций концентрация твердой фазы в кинетическое уравнение не входит!
Для гомогенных химических реакций в газовых смесях скорость химической реакции может быть выражена не только через молярные концентрации веществ, но и через парциальные давления компонентов.
Парциальным давлением (pi) газа в газовой смеси называют давление, которое бы оказывал этот газ, если бы из смеси были удалены все остальные газы при условии сохранения первоначальных объема и температуры. Согласно закону Дальтона общее давление газовой смеси, состоящей из идеальных газов, равно сумме парциальных давлений каждого газа:
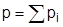 . .
| (5) |
Закон действующих масс, записанный для реакции (3) через парциальные давления будет иметь вид:
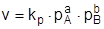 , ,
| (6) |
где – pA и pB парциальные давления веществ A и B соответственно, a и b - стехиометрические коэффициенты в уравнении реакции; kp - константа скорости химической реакции, выраженная через парциальные давления.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2175; Нарушение авторских прав?; Мы поможем в написании вашей работы!