
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры. Уравнение Аррениуса
|
|
|
|
Влияние площади межфазной поверхности. Порошковая металлургия
В гетерогенных системах (т.е., когда вещества находятся в разных фазах, например, разных агрегатных состояниях) химическая реакция идет на межфазной поверхности. Поэтому, чем больше поверхность соприкосновения реагентов, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, поскольку отношение площади поверхности к массе у мелких частиц больше, чем у крупных.
Следует также отметить, что кроме площади реакционной поверхности на скорость гетерогенных реакций существенное влияние оказывает скорость подвода реагирующих веществ к межфазной поверхности (скорость диффузии) и скорость отвода продуктов реакции.
Возможность влияния на скорость химической реакции путем изменения площади межфазной поверхности (измельчения реагентов) широко используется в порошковой металлургии.
Порошковая металлургия – область науки и техники, охватывающая совокупность методов изготовления порошков металлов, сплавов и металлоподобных соединений, полуфабрикатов и изделий из них или их смесей с неметаллическими порошками без расплавления основного компонента. Основоположниками современного этапа порошковой металлургии являются российские ученые П.Г. Соболевский и В.В. Любарский, разработавшие в 1826-1827 гг. метод получения изделий из порошка платины.
Порошковая металлургия включает в себя следующие группы технологических операций: получение исходных металлических порошков, приготовление из них шихты (смеси), компактирование в заготовки и спекание. Порошки, используемые в порошковой металлургии, имеют средний размер 001 – 500 мкм.
Методами порошковой металлургии получают триботехнические материалы, отличающиеся высокой износостойкостью и хорошей прирабатываемостью, фильтры, электротехнические, высокотемпературные и твердосплавные материалы.
В Республике Беларусь исследования в области порошковой металлургии ведутся с 1957 года. В настоящее время Научно-исследовательский институт порошковой металлургии (г. Минск) входит в Европейскую ассоциацию порошковой металлургии (EPMA).
Скорость химической реакции в очень сильной степени зависит от температуры. Для реакций, протекающих при обычных температурах (0 - 100°С) зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа:
При повышении температуры на каждые 10°С скорость большинства химических реакций увеличивается в 2 – 4 раза.
Правило Вант-Гоффа можно выразить в виде формулы:
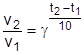 , ,
| (7) |
где v1 и v2 – скорость реакции соответственно при температурах t1 и t2 соответственно; g – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°С.
Правило Вант-Гоффа имеет ограниченную применимость. Так, результаты, полученные с его помощью, не соответствуют экспериментальным данным для реакций, протекающих при очень высоких и очень низких температурах.
Для точного расчета зависимости скорости химической реакции температуры в 1889 году шведским ученым Сванте Аррениусом была предложена теория активных столкновений, являющейся продолжением кинетической теории газов. Теория активных столкновений основывается на трех основных положениях:
- химическая реакция протекает только в результате столкновения частиц реагирующих веществ;
- каждое столкновение может приводить к реакции только в том случае. Если его энергия превосходит некоторую минимальную энергию;
- каждое столкновение приводит к реакции только в том случае, если сталкивающиеся частицы определенным образом ориентированы друг по отношению к другу.
На основании данной теории было выведено уравнение, показывающее зависимость константы скорости химической реакции от температуры, получившее название уравнения Аррениуса:
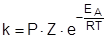 , ,
| (8) |
где P – стерический фактор, характеризующий вероятность определенной геометрической конфигурации частиц при столкновении; может принимать значения от 0 до 1; Z – число эффективных столкновений частиц реагентов в единицу времени в единице реакционного объема (или на единице реакционной поверхности); e – основание натуральных логарифмов (e = 2,718...); ЕА – энергия активации; R – универсальная газовая постоянная (8,314 Дж / моль×K); Т – температура.
Энергия активации (ЕА) является важнейшей энергетической характеристикой химической реакции. Она определяется как энергия, которую надо сообщить частицам реагирующих веществ, чтобы превратить их в активные, т.е. реакционноспособные. Фактически энергия активация является той минимальной энергией, которой должны обладать частицы реагирующих веществ, чтобы при столкновении между ними произошла химическая реакция. Энергия активации практически не зависит от температуры и определяется природой реагирующих веществ. Для большинства химических реакций ЕА меньше энергии наименее прочной связи в частицах реагирующих веществ и находится в пределах от 40 до 400 кДж/моль. Однако существуют реакции, протекающие с нулевой энергией активации.
Часто в уравнении (8) два множителя P и Z объединяют вместе в предэкспоненциальный множитель A:
 . .
| (9) |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1275; Нарушение авторских прав?; Мы поможем в написании вашей работы!