
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория переходного состояния. Энергетические диаграммы
|
|
|
|
Несмотря на ряд достоинств, теория активных столкновений, рассмотренная в предыдущей главе, обладает некоторыми недостатками. Так, она не объясняет влияние на скорость химической реакции природы растворителя, давления, добавок инертных газов и т.д. В значительной степени эти недостатки учтены в теории переходного состояния. Данная теория разработана в 1935 году американским ученым Генри Эйрингом и английским ученым Майклом Поляни. Теория переходного состояния основывается на тех же принципах, что теория активных столкновений. Однако, в отличие от нее, считается, что химическая реакция взаимодействия между молекулами протекает не мгновенно, а в течение некоторого промежутка времени. При этом происходит постепенная перестройка химических связей, при котором начальная конфигурация атомов в исходных молекулах переходит в конечную у продуктов реакции при непрерывном изменении межатомных расстояний.
Путь перехода от частиц реагирующих веществ к частицам продуктов реакции по поверхности потенциальной энергии называется координатой реакции.
Рассмотрим механизм химической реакции
A2 + B2 = 2AB.
При сближении реагирующих молекул начинается взаимодействие между ними, в результате которого химические связи A – A и B – B постепенно ослабляются. Одновременно начинают формироваться новые химические связи A – B и B – A, которые постепенно усиливаются. В какой-то момент времени в системе образуется комплекс, состоящий из двух реагирующих молекул и имеющий характерные черты, как исходных молекул, так и будущих продуктов реакции (A2B2¹). Такой комплекс называется активированным. Активированный комплекс ни в коем случае не является стабильной молекулой или каким-либо промежуточным соединением, его энергия максимальна, он не может существовать продолжительное время и распадается либо на исходные молекулы, либо на продукты реакции. В этом случае связи A – B и B – A становятся полноценными, а связи A – A и B – B – разрываются (рис. 1.2.).
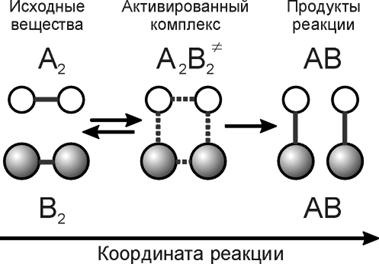
Рис. 1.2. Схема перестройки химических связей в ходе реакции.
Если построить график изменения потенциальной энергии вдоль координаты реакции можно получить энергетические диаграммы (рис. 1.3.). При этом возможно два случая. В случае, когда потенциальная энергия исходных веществ выше энергии продуктов, в ходе химической реакции данная разница в энергии выделяется в форме теплоты (экзотермическая реакция, DH<0). Если же потенциальная энергия исходных веществ ниже энергии продуктов, нужна дополнительная теплота, чтобы данную разницу в энергии компенсировать (эндотермическая реакция, DH>0).
Кроме того, энергетические диаграммы поясняют физический смысл энергии активации. В теории переходного состояния ЕА является энергетическим барьером, который система должна преодолеть, чтобы перейти от исходных веществ к продуктам реакции. Именно из-за высокого значения энергии активации в нормальных условиях практически не идут многие реакции, которые могут протекать самопроизвольно (DG<0).
Теория переходного состояния с высокой степенью точности описывает кинетику большинства реакций. Однако при очень низких температурах (<10 K) наблюдаются очень значительные (на несколько порядков) отклонения константы скорости реакции от теоретически рассчитанной. Это обусловлено туннельным эффектом, при котором реагирующие частицы могут проходить сквозь энергетический барьер. Механизм такого явления объясняет квантовая химия.

экзотермическая реакция эндотермическая реакция
Рис. 1.3. Энергетические диаграммы простых реакций
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1618; Нарушение авторских прав?; Мы поможем в написании вашей работы!